В практическом руководстве отображена информация по вопросам изучения антибиотикорезистентности зоонозных и индикаторных бактерий, полученных от продуктивных животных. Представлены основные подходы к транспортировке, хранению биоматериала и подготовке для последующего исследования. Дана информация об этапах работы с биоматериалом, направленных на выделение, идентификацию и определение чувствительности микроорганизмов к антибактериальных препаратам. Описаны варианты работы с онлайн-платформой AMRcloud для анализа и визуализации данных антибиотикорезистентности зоонозных и индикаторных бактерий, полученных от продуктивных животных. Руководство будет полезно для специалистов в области ветеринарии, микробиологии, эпидемиологии, и специалистов, заинтересованных в вопросах мониторинга антибиотикорезистентности микроорганизмов.
Это многостраничный вид для печати этого раздела. Нажмите здесь для печати.
Антибиотикорезистентность зоонозных и индикаторных бактерий, выделяемых от продуктивных животных
- Список сокращений
- 1. Области применения руководства
- 2. Цели исследования антибиотикорезистентности зоонозных и индикаторных бактерий, выделяемых от продуктивных животных
- 3. Системы мониторинга и источники данных об антибиотикорезистентности зоонозных и индикаторных бактерий, выделяемых от животных
- 4. Планирование и организация исследований
- 4.1 Бактерии
- 4.2 Антимикробные препараты
- 4.3 Виды и категории животных
- 4.4 Тип образца
- 4.5 Планирование отбора образцов
- 4.6 Отбор, маркировка, хранение и транспортировка образцов
- 5. Выделение и идентификация бактерий
- 5.1 Методы выделения и идентификации Escherichia coli
- 5.2 Метод выделения и идентификации Salmonella spp.
- 5.3 Метод выделения и идентификации Campylobacter spp.
- 5.4 Метод выделения и идентификации Enterococcus spp.
- 6. Определение чувствительности бактерий к антибиотикам
- 7. Работа с AMRcloud
- 8. Пример решения практической задачи, связанной с мониторингом устойчивости зоонозных бактерий, выделенных от животных
- Литература
Список сокращений
| Сокращение | Полное наименование |
|---|---|
| ATCC | Американская коллекция типовых культур (American Type Culture Collection) |
| CCDC | Китайский центр по контролю и профилактике заболеваний (Chinese Center for Disease and Control Prevention) |
| CDC | Центры предотвращения и борьбы с заболеваниями США (Centers for Disease and Control Prevention) |
| СLSI | Институт клинических и лабораторных стандартов США (Сlinical and Laboratory Standards Institute) |
| ECDC | Европейский центр профилактики и борьбы с заболеваниями (European Centre for Disease Prevention and Control) |
| ECOFF | Точка отсечения микробиологической (эпидемиологической) устойчивости (Epidemiological cut-off value) |
| EFSA | Европейское агентство по безопасности продуктов питания (European Food Safety Authority) |
| ESBL | Бета-лактамазы расширенного спектра (БЛРС) (Extended Spectrum Beta-Lactamases) |
| EMA | Европейское медицинское агентство (European Medicines Agency) |
| EUCAST | Европейский комитет по определению чувствительности к антимикробным средствам (European Comitte of Antimicrobial Susceptibility Testing) |
| FDA | Управления по контролю продуктов питания и лекарственных средств (Food and Drug Administration) |
| NARMS | Система национального мониторинга антибиотикорезистентности США (National System of Antimicrobial Monitoring Resistance) |
| MALDI-TOF MS | матрично-активированная лазерная деcорбционно/ионизационная времяпролетная масс-спектрометрия (Matrix-assisted laser desorption ionization mass spectrometry) |
| MRSA | Метициллин-резистентный золотистый стафилококк (Methicillin-resistant Staphylococcus aureus) |
| ВОЗ | Всемирная организация здравоохранения, англ. WHO (World Health Organization) |
| КРС | крупный рогатый скот |
| МПК (MIC) | минимальная подавляющая концентрация (minimum inhibitory concentration) |
| МЭБ | Всемирная организация здравоохранения животных, бывш. Международное эпизоотическое бюро, англ. WOAH (World Organization for Animal Health) |
| ФАО | Всемирная продовольственная и сельскохозяйственная организация, англ. FAO (Food and Agriculture Organization) |
1. Области применения руководства
Настоящее руководство предназначено в качестве методологической помощи при планировании и проведении исследований чувствительности к антимикробным препаратам бактерий, выделяемых от продуктивных животных. Руководство посвящено выбору животных, бактерий, антибиотиков, типов отбираемых образцов, методологии определения чувствительности и т.д., а также анализу и представлению данных с использованием онлайн-платформы AMRcloud.
В область применения руководства входят исследования зоонозных и комменсальных бактерий, выделяемых от здоровых продуктивных животных, информация не распространяется на клинические патогены животных. Таким образом, эти исследования предназначены в первую очередь для сферы охраны здоровья людей путём предотвращения передачи от животных устойчивых к АМП микроорганизмов. Однако рассматриваемые зоонозные и индикаторные бактерии способны также вызывать заболевания и у животных, таким образом, данные об их устойчивости представляют ценность и для ветеринарной сферы.
Зоонозные бактерии — это бактерии, которые передаются человеку от животных и могут вызывать заболевания у человека, например, сальмонеллы и кампилобактерии. Профиль резистентности таких возбудителей важен с эпидемиологической точки зрения и для принятия управленческих мер по оптимизации применения антибиотиков в сельском хозяйстве, а не с точки зрения лечения пациентов.
Индикаторные бактерии — это комменсальные бактерии, часть естественной микробиоты ЖКТ животных, которые могут передаваться человеку, но заболевания вызывают, как правило, только у лиц с ослабленным иммунитетом или, если произошло заражение патогенным для человека штаммом. Исследование профиля их резистентности важно для оценки общего уровня устойчивости штаммов у продуктивных животных, при этом необходимо помнить, что устойчивые комменсальные бактерии могут являться источником для передачи и распространения механизмов устойчивости к АМП.
К индикаторным бактериям относят E. coli и Enterococcus spp. Всемирная организация здравоохранения (ВОЗ), Всемирная сельскохозяйственная и продовольственная организация (ФАО) и Всемирная организация здравоохранения животных (МЭБ) в рамках подхода «единое здоровье» рассматривает E. coli как главный индикаторный микроорганизм, являющийся точкой соприкосновения исследований микроорганизмов, выделенных от людей, животных и из объектов окружающей среды.
Необходимо учесть, что при изучении чувствительности выделенных бактерий к антибиотикам, их идентификация может происходить только до вида, а не до серовара или штамма. Таким образом, исследуя произвольный изолят E. coli, нельзя сказать, что это — комменсальная бактерия или высокопатогенный штамм E. coli O157:H7. В то же время и не все штаммы Salmonella entericа патогенны для человека. Поэтому деление на патогенные и индикаторные бактерии в значительной степени условно, и международные организации, в частности, МЭБ, рассматривают ту же E. coli в качестве как зоонозной, так и комменсальной бактерии.
Бактерии для мониторинга (определения) устойчивости могут быть отобраны как из биоматериала, полученного от животных, так и из пищевой продукции, в том числе из розничной торговли. Целесообразность отбора готовой продукции, и полуфабрикатов, например, фарша, является спорной, т.к. в этом случае высока вероятность, что источником выделенных бактерий будет человек, а не животное, в связи с чем руководство распространяется только на пищевое сырьё (мясо, субпродукты, молоко, яйца, рыбу).
Выявление генетических маркеров резистентности также не входит в область применения настоящего руководства.
Авторы приглашают читателей к сотрудничеству. Комментарии, критические замечания, вопросы и пожелания можно направлять на электронную почту: support@antibiotic.ru.
2. Цели исследования антибиотикорезистентности зоонозных и индикаторных бактерий, выделяемых от продуктивных животных
Определение профиля чувствительности к АМП выделенного от продуктивного животного изолята преследует следующие цели:
- Проведение оценки устойчивости патогенных для человека и животных бактерий для эпидемиологического надзора за распространением устойчивых изолятов в рамках концепции «Единого здоровья».
- Получение научных данных, позволяющих понять механизмы возникновения и распространения антибиотикорезистентности бактерий в животноводческих хозяйствах.
- Получение данных, необходимых для принятия управленческих мер, направленных на борьбу с распространением устойчивости, главная из которых в животноводстве — сокращение и оптимизация использования антибиотиков.
- Определение бактерий, приоритетных для разработки/внедрения новых антибиотиков в медицине и ветеринарии.
- Оценка эффективности уже внедрённых в практику мер.
Исследования антибиотикорезистентности следует проводить непрерывно, на ежегодной основе, фиксируя различия в устойчивости в одних и тех же хозяйствах.
3. Системы мониторинга и источники данных об антибиотикорезистентности зоонозных и индикаторных бактерий, выделяемых от животных
Устойчивость микроорганизмов к антибиотикам — это проблема мирового масштаба. С учётом распространения резистентных бактерий и генов устойчивости по всей планете, усугубляемого глобализацией, данная проблема даже в отдельно взятой стране не может быть полностью решена усилиями только этой страны. По этой причине данные, получаемые в исследованиях антибиотикорезистентности, представляют большую ценность не только на национальном, но и на международном уровне. Чем меньше на карте останется регионов, по которым отсутствуют данные, тем более эффективной будет разработка мер по борьбе с распространением устойчивости. Важно отметить, что планирование исследований антибиотикорезистентности следует осуществлять с использованием международно признанных принципов, подходов и методологии.
Исследования антибиотикорезистентности зоонозных и индикаторных бактерий, выделяемых от животных, проводят множество научных и контрольных институтов и лабораторий по всему миру. Результаты исследований публикуются в виде отчётов, баз данных и научных статей.
Большую роль в разработке международно признанных подходов и методологии проведения таких исследований играют Всемирная организация здравоохранения (ВОЗ), Всемирная сельскохозяйственная и продовольственная организация (ФАО) и Всемирная организация здравоохранения животных (МЭБ).
Указанные организации разработали и продвигают подход «Единое здоровье», предполагающий координированные усилия разных стран в вопросах защиты здоровья человека, животных и окружающей среды с учётом их теснейшей связи.
В 2019 г. триумвират ВОЗ, ФАО и МЭБ выпустил «Трёхстороннее руководство, по борьбе с зоонозными заболевания на уровне государств». В этом документе звучит призыв к гармонизации усилий разных стран в анализе антибиотикорезистентности зоонозных бактерий прежде всего путём гармонизации методологии [1] .
По отношению к системе мониторинга антибиотикорезистентности бактерий, выделяемых от животных, страны мира можно разделить на 4 категории:
- Страны, объединённые в союзы, которые проводят мониторинг устойчивости совместно и централизованно на уровне союза, объединяя данные из стран-участников (Пример — Евросоюз).
- Страны, которые имеют национальную систему мониторинга, собирающую данные по всей стране (Пример — США).
- Страны, не имеющие системы мониторинга, но активно осуществляющие разрозненные проекты и работы по исследованию устойчивости (Пример — Китай, Российская Федерация, Бразилия).
- Страны, не имеющие на данный момент технической возможности проводить исследования антибиотикорезистентности бактерий от животных (Эти страны расположены главным образом в Африке, Азии, Латинской Америке).
3.1 Евросоюз
Евросоюз осуществляет мониторинг антибиотикорезистентности зоонозных и индикаторных бактерий, выделяемых от людей, животных и из продуктов питания. Данные, предоставляемые 28-ю странами-участниками Евросоюза, собирают и анализируют Европейское агентство по безопасности продуктов питания (EFSA, European Food Safety Authority) и Европейский центр профилактики и предотвращения заболеваний (ECDC, European Centre for Disease Prevention and Control).
ECDC и EFSA публикуют данные в виде ежегодных отчётов. Отчёт за текущий год содержит данные, полученные двумя-тремя годами ранее. Например, в 2022 году организации выпустили отчёт с данными 2019–2020 годов. Такая задержка во времени связана, по всей видимости, с трудоёмкостью анализа массивов данных, полученных в 28 разных странах.
В программу мониторинга входят Salmonella spp., E. coli, S. aureus (зоонозные бактерии) и E. coli (индикаторная бактерия). В разные годы бактерии выделяют от разных видов и категорий животных.
Отчёты ЕСDC/EFSA внушительны по объёму и тщательности проработки материала, содержат данные как по клинической, так и по микробиологической устойчивости, сведения о множественной резистентности бактерий, географическом распределении устойчивости, изменении её по годам, генах устойчивости и т.д. Все отчёты выложены в свободном доступе на официальном сайте ECDC [2] .
Также данные мониторинга устойчивости бактерий, выделяемых от животных в Евросоюзе, доступны в виде совместной базы данных ECDC/EFSA «Antimicrobial resistance in Europe» (Антибиотикорезистентность в Европе) [3] . Данные в базе соответствуют данным из отчетов, но они представлены в сокращенном виде. При использовании базы данных можно переключаться между разными годами, выбирать вид микроорганизма, объект, например, цыплята-бройлеры (раздел «животное») или мясо индейки (раздел «пищевая продукция»). Информация может быть представлена в двух вариантах: либо выбор антибиотика из списка — тогда будет графически отображена доля устойчивых к нему изолятов в разных странах Евросоюза, либо выбор страны из списка — тогда будет отображена доля устойчивых изолятов из этой страны к разным антибиотикам.
3.2 США
В США в рамках деятельности Управления по контролю продуктов питания и лекарственных средств (FDA, Food and Drug Administration) с 1996 г. работает Cистема национального мониторинга антибиотикорезистентности (NARMS, National System of Antimicrobial Monitoring Resistance), регулярно публикующая отчёты о бактериях, выделенных от убойных животных (свиней, коров, кур и индеек, полученном от них мясе из розничной торговли, а также сведения о бактериях, выделенных от людей. Акцент делается на наиболее актуальные для страны патогенные бактерии, возбудители пищевых токсикоинфекций: Salmonella spp., E.coli, Enterococcus spp. и Campylobacter spp. В качестве зоонозных бактерий рассматриваются Salmonella spp. и Campylobacter spp., а индикаторных — Enterococcus spp. и E.coli.
Все данные мониторинга устойчивости публикуются на официальном сайте FDA и наиболее удобны к просмотру в виде базы данных NARMS Now: Integrated Data (NARMS в настоящее время: объединённые данные) [4] , которая включает информацию по устойчивости изолятов с 90-х годов ХХ века.
База состоит из модулей, демонстрирующих устойчивость:
- по годам;
- множественную устойчивость;
- распределение устойчивых изолятов в зависимости от географического расположения.
3.3 Китай
Китай является примером страны, в которой выполняются отдельные проекты (нередко масштабные) по оценке устойчивости микроорганизмов, выделяемых от животных, но при этом нет централизованной системы мониторинга. Например, несколькими китайскими научными институтами и лабораториями проведена работа с результатами анализа более 15000 изолятов E. coli от свиней и кур из разных провинций Китая за семилетний период [5] .
Данные подобных исследований публикуют в научных журналах (в платном, либо бесплатном доступе), или сайтах контролирующих органов, в частности, Китайского центра предотвращения и борьбы с заболеваниями (CDC, China Center for Disease and Control Prevention) в официальном еженедельнике, например, отчёте об исследовании устойчивости сальмонеллы от разных видов животных [6] .
3.4 Российская Федерация
В Российской Федерации централизованная система мониторинга антимикробной резистентности бактерий, выделяемых от животных, отсутствует. Однако существуют исследовательские группы, активно занимающиеся накоплением данных в этой области.
Между тем, различные учреждения, связанные с ветеринарией и медициной, активно проводят соответствующие исследования.
ФГБУ «ВГНКИ» (Всероссийский государственный центр качества и стандартизации лекарственных средств для животных и кормов, г. Москва), являющийся одним из научных институтов Россельхознадзора (Федеральной службы по ветеринарному и фитосанитарному надзору) исследует устойчивость E. coli, Enterococcus spp., Salmonella spp., Campylobacter spp., Staphylococcus spp., Listeria monocytogenes. Бактерии выделяют от птицы (куры, индейки, утки, гуси), коров, свиней, овец и коз. Географический охват исследований составляет 33 региона РФ от Калининградской области до Приморского края. В программу входит 31 антибактериальный препарат из 16 классов. Результаты исследований ФГБУ «ВГНКИ» представлены в свободном доступе в виде открытого проекта на платформе AMRcloud [7] . Также учреждение публикует соответствующие научные статьи.
ФГБУ «ВНИИЗЖ» (Федеральный центр охраны здоровья животных, г. Владимир) является одним из научных институтов Россельхознадзора, проводит исследования антибиотикорезистентности зоонозных бактерий, выделяемых из пищевого сырья и продукции животного происхождения, в частности, Salmonella spp. и Listeria spp. Результаты исследования учреждение публикует, в частности, в собственном журнале открытого доступа «Ветеринария сегодня» [8] .
В 2014 г. ФГБУ «ЦНМВЛ» (Центральная научно-методическая ветеринарная лаборатория) выпустила отчёт «Анализ эпидемиологической ситуации с сальмонеллой в Российской Федерации» с данными по Salmonella spp., полученными от крупного рогатого скота (КРС), свиней, кур, овец, лошадей, пчёл и других животных. Несколько десятков тысяч изолятов были проанализированы региональными ветеринарными лабораториями. К сожалению, при всей масштабности исследований, в отчёте не были указаны использованные критерии интерпретации, что затрудняет анализ полученных сведений и является иллюстрацией необходимости гармонизации подходов к исследованиям антибиотикорезистентности.
Роспотребнадзор (Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека) проводит исследования антибиотикорезистентности зоонозных бактерий, в частности сальмонелл, выделенных от людей, из продуктов питания и внешних объектов. Результаты исследования организация публикует в государственных докладах. Последний на текущий момент доклад вышел в 2022 г. и содержит данные за 2021 г. Доклад выложен в свободном доступе на официальном сайте ведомства [9] .
Несмотря на то что исследования антибиотикорезистентности бактерий, выделяемых от зоонозных и комменсальных животных, проводят и другие научные учреждения, связанные с ветеринарной и медицинской сферами, в РФ статьи и отчёты, посвящённые соответствующим исследованиям, выходят в достаточно малом количестве.
Отечественные и зарубежные публикации и отчёты с данными об антибиотикорезистентности могут быть легко найдены через поисковые системы (Google, Яндекс, Pubmed и elibrary.ru).
В таблице 1 представлена подборка исследований антибиотикорезистентности E. coli, Enterococcus spp., Salmonella spp., Staphylococcus spp., Listeria spp., Campylobacter spp. и Streptococcus spp. выделенных от животных и из продуктов питания. Подборка даёт представление о характере проведения подобных исследований в России. Исследования бактерий от животных с клиническими признаками заболеваний не были включены.
Таблица 1. Отечественные публикации, посвящённые антибиотикорезистентности зоонозных бактерий, выделенныхот животных и из продуктов питания
| Микроорганизм | Источник | Учреждение | Публикация |
| E. coli | Продуктивные животные | Всероссийский государствен- ный центр качества и стан- дартизации лекарственных средств для животных и кор- мов (ФГБУ «ВГНКИ») | Makarov D.A., Ivanova O.E., Karabanov S.Y. et al. Antimicrobial resistance of commensal Escherichia coli from food-producing animals in Russia. Veterinary World, 2020, №13 (10), pp. 2053–2061. |
| E. coli | Продуктивные животные | Уральский федеральный аграрный научно-исследова- тельский центр УрО РАН | Безбородова Н.А, Соколова О.В, Кривоногова А.С. и др. Фенотипическая и гено- типическая антибиотикорезистентность бактерий семейства Enterobacteriaceae, выделенных в сель- скохозяйственных предприятиях уральского ре- гиона. Труды кубанского государственного аграр- ного университета, 2021, №92, с. 201–210. |
| Enterococcus faecalis и Enterococcus faecium | Продуктивные животные | ФГБУ «ВГНКИ» | Makarov D.A, Ivanova OE, Pomazkova AV et al. Antimicrobial resistance of commensal Enterococcus faecalis and Enterococcus faecium from food- producing animals in Russia. Veterinary World, 2022, №15 (3), pp. 611–621. |
| E. coli, Salmo nella spp., Entero coccus faecalis, Enterococcus faecium | Пищевая продукция | Федеральный исследователь- ский центр питания, био- технологии и безопасности пищи | Короткевич Ю.В. Изучение антибиотикоре- зистентности микроорганизмов, выделенных из пищевых продуктов. Вопросы питания, 2016, Том 85, №S2 (85), c. 142. |
| E. coli, Enterococcus spp. | Пищевая продукция | Российский биотехнологический университет Федеральный исследовательский центр питания, биотехнологии и безопасности пищи | Сибиркина М.М, Нитяга И.М., Смотрина Ю.В. Оценка частоты и спектра антибиотикорезистентности у E. coli и Enterococcus spp., выделенных из пищевой продукции. Российский журнал проблемы ветеринарной санитарии, гигиены и экологии? 2019, №3 (43), c. 299–304. |
| Enterococcus spp., Streptococcus spp. | Птица | Московская государственная академия ветеринарной медицины и биотехнологии — МВА им. К.И. Скрябина | Литвинов О.Б., Брылина В.Е., Садовая Е.Е. и др. Видовая идентификация и антибиотикорезистентность бактерий рода Streptococcus spp. и Enterococcus spp., выделенных от сельскохозяйственной птицы. Актуальные проблемы ветеринарной медицины, зоотехнии, биотехнологии и экспертизы сырья и продуктов животного происхождения. Сборник трудов научно-практической конференции. Под общей редакцией С.В. Позябина, Л.А. Гнездиловой. Москва, 2022, с. 302–304. |
| Enterococcus spp. | Птица | ФБУН «Государственный научный центр прикладной микробиологии и биотехнологии» | Светоч Э.А., Теймуразов М.Г., Тазина О.И. Антибиотикорезистентность культур Enterococcus spp., выделенных от промышленной пти- цы в 2013–2016 гг. в хозяйствах Российской Федерации, и детекция у них генов резистентности к ванкомицину. Альманах клинической медицины, 2017, №45 (2), с. 138–146. |
| Enterococcus spp. | Птица | ФГБОУ ВО Оренбургский государственный аграрный университет | Кочкина Е.Е., Дымова В.В., Абоимова А.А. и др. Устойчивость к антибактериальным препара- там энтерококков, выделенных из микробио- ты кишечника цыплят-бройлеров: фенотипиче- ская характеристика и генетический контроль. Современные тенденции развития ветеринарной науки и практики. Материалы Национальной (Всероссийской) научно-практической конфе- ренции. Омск, 2021, с. 311–317. |
| Salmonella spp. | Пищевая продукция | ФГБУ Федеральный центр охраны здоровья животных | Шмайхель С.Е., Шадрова Н.Б., Ерофеева Е.С. и др. Серологические свойства и антибиотикоре- зистентность изолятов бактерий рода Salmonella, выделенных из сырья животного происхождения. Ветеринария сегодня, 2019, №4, с. 25–30. |
| Salmonella spp. | Пищевая продукция | ФГБУ Федеральный центр охраны здоровья животных | Шадрова Н.Б., Прунтова О.В., Корчагина Е.А. Антибиотикорезистентность изолятов сальмонелл, выделенных из продуктов животного происхождения. Ветеринария сегодня, 2022, №11 (1), с. 27–34. |
| Salmonella spp. | Пищевая продукция | ФГБУ Федеральный центр охраны здоровья животных | Скитович Г.С., Шадрова Н.Б., Прунтова О.В. и др. Идентификация и антибиотикорезистентность изолятов бактерий рода Salmonella. Ветеринария сегодня, 2018, №4, с. 3–11. |
| Salmonella spp. | Пищевая продукция | ФГБУ Федеральный центр охраны здоровья животных | Skitovich G., Serova K., Korchagina. Antimicrobial resistance Salmonella isolates recovered from food products of animal origin in the Russian Federation. Access Microbiology, № 2 (7А). |
| Salmonella spp. | Продуктивные животные и пищевая продукция | ФГБОУ ВО Санкт-Петербургский государственный университет ветеринарной медицины | Кузнецова Н.А., Соловьева А.С., Раков А.В. Чувствительность к антибиотикам у штаммов Salmonella. Здоровье. Медицинская экология. Наука, 2018, №3 (75), с. 50–58. |
| Salmonella spp. | Пищевая продукция | ФГБОУ ВО Владимирский государственный университет им. А.Г. и Н.Г. Столетовых | Ручнова О.И., Куркина Е.С. Биологические свойства изолятов бактерий рода Salmonella. Евразийский Союз Ученых, 2016, №30–1, с. 11–14. |
| Salmonella spp. | Продуктивные животные и пищевая продукция | ФГБУ «ВНИИЗЖ» ФГБОУ «Московская государственная академия ветеринарной медицины и биотехнологии — МВА им. К.И. Скрябина» | Виткова О.Н., Иванова О.Е., Базарбаев С.Б. и др. Изучение антибитикорезистентности сальмонелл, выделенных от животных и из пищевых продуктов животного происхождения на территории Российской Федерации. Ветеринария Кубани, 2015, №2, с. 11–15. |
| Salmonella spp. | Пищевая продукция | Институт биоинженерии им. К.Г. Скрябина, ФНЦ пищевых систем им. В.М. Горбатова, Федеральный исследовательский центр вирусологии и микробиологии, Национальный исследовательский центр эпидемиологии и микробиологии им. Н.Ф. Гамалеи | Rakitin A.L., Yushina Y.K., Zaiko E.V. et al. Evaluation of Antibiotic Resistance of Salmonella Serotypes and Whole-Genome Sequencing of Multiresistant Strains Isolated from Food Products in Russia. Antibiotics (Basel), 2021, №11 (1), pp. 1–20. |
| Сampylobacter jejuni | Пищевая продукция | Федеральный исследовательский центр питания, биотехнологии и безопасности пищи | Ефимочкина Н.Р., Короткевич Ю.В., Стецен- ко В.В. и др. Антибиотикорезистентность штаммов Campylobacter jejuni, выделенных из пищевых продуктов. Вопросы питания, 2017, № 1 (86), с. 17–27. |
| Сampylobacter jejuni | Продукция птицеводства | Санкт-Петербургский госу- дарственный университет ве- теринарной медицины Федеральный научный центр — Всероссийский науч- но-исследовательский инсти- тут экспериментальной вете- ринарии им. К.И. Скрябина и Я.Р. Коваленко РАН | Смирнова Л.И., Макавчик С.А., Сухинин А.А. Чувствительность к антибактериальным препа- ратам Сampylobacter jejuni, выделенных из птице- продуктов. Ветеринария и кормление, 2021, №6, с. 53–56. |
| Campylobacter jejuni, Campylobacter coli и др. | Пищевая продукция | ФИЦ Питания и биотехнологии | Стеценко В.В. Видовая структура и характери- стика биопрофилей возбудителей пищевого кампилобактериоза, выделенных из пищевой продукции и объектов окружающей среды. Вопросы питания, 2016, №S2 (85), c. 244–245. |
| Listeria monocytogenes | Пищевая продукция | ФГБУ «ВНИИЗЖ» | Скитович Г.С., Серова К.В., Шадрова Н.Б., Прунтова О.В. Антибиотикочувствительность листерий, выделенных из пищевых продуктов. Ветеринария сегодня, 2017, № 2, с. 13–16. |
| Staphylococcus aureus | Молоко и молочная продукция | ФГБУ «ВНИИЗЖ» | Бородкина И.В. Биологические свойства изоля- тов Staphylococcus aureus, выделенных из молока и молочной продукции, произведенных на территории республики Крым. Ветеринария сегодня, 2019, № 4, с. 13–18. |
| Staphylococcus aureus | Молоко | ФГБНУ Всероссийский НИИ животноводства им. академи- ка Л.К. Эрнста | Артемьева О.А., Никанова Д.А., Котковская Е.Н., Гладырь Е.А., Доцев А.В., Зиновьева Н.А. Антибиотикорезистентность штаммов Staphylococcus aureus, выделенных из молока вы- сокопродуктивных коров. Agricultural Biology, 2016, №6. |
| Staphylococcus aureus | Продуктивные животные | ФГБОУ ВО «Санкт- Петербургский государ- ственный университет ве- теринарной медицины», ФГБУ «Ленинградская Межобластная ветеринарная лаборатория» | Макавчик С.А., Кротова А.Л. Антибиотикорезистентность микроорганизмов Staphylococcus aureus, изолированных от живот- ных. международный вестник ветеринарии, 2021, № 3, с. 103–107. |
| Staphylococcus spp, E. coli, Enterococcus spp., Salmonella spp., Streptococcus spp. | Продуктивные животные | Омский государственный аграрный университет им. П.А. Столыпина | Ручко Е.Н., Лещева Н.А., Плешакова В.И. Антибиотикорезистентность микроорганизмов рода Staphylococcus, выделенных от животных Омской области. Вестник КрасГАУ, 2022, №8 (185). |
| Listeria monocytogenes | Продуктивные животные, пищевая продукция | Федеральный центр вирусологии и микробиологии, Национальный исследовательский центр эпидемиологии и микробиологии им. Н.Ф. Гамалеи, ФНЦ пищевых систем им. В.М. Горбатова» | Andriyanov PA, Zhurilov PA, Liskova EA, Karpova TI, Sokolova EV, Yushina YK, Zaiko EV, Batae- va DS, Voronina OL, Psareva EK, Tartakovsky IS, Kolbasov DV, Ermolaeva SA. Antimicrobial Resistance of Listeria monocytogenes Strains Isolated from Humans, Animals, and Food Products in Russia in 1950–1980, 2000–2005, and 2018–2021. Antibiotics (Basel), 2021, №10 (10), p. 1206. |
4. Планирование и организация исследований
В ходе планирования исследований антибиотикорезистентности следует учесть как можно больше составляющих. Если участники исследования без должной тщательности подойдут к их выбору и оценке, то в результате могут быть получены данные, имеющие низкую научную и практическую значимость. Рекомендуемые этапы мониторинга представлены на рисунке 1.

4.1 Бактерии
При условии отсутствия задачи по исследованию конкретной бактерии и с учётом отсутствия в Российской Федерации официально утверждённого списка выделяемых от животных бактерий, приоритетных для исследований антибиотикорезистентности, предлагаем основывать выбор бактерий на рекомендациях упомянутых выше международных организаций: МЭБ, ВОЗ и ФАО.
МЭБ в главе 6.8 Кодекса здоровья наземных животных [10] предлагает включать в программы исследования антибиотикорезистентности:
- Зоонозные бактерии:
- в первую очередь Salmonella spp. и Campylobacter spp.
- Staphylococcus aureus (Метициллин-резистентный золотистый стафилококк, MRSA) и Listeria monocytogenes
- Комменсальные бактерии:
- E. coli
- Enterococcus faecium
- Enterococcus faecalis
ВОЗ в Объединённом руководстве по исследованиям антибиотикорезистентности бактерий — возбудителей пищевых токсикоинфекций [11] , посвящённому в том числе и исследованию бактерий от животных, указывает, что наиболее часто в программы мониторинга антибиотикорезистентности включают Salmonella spp., Campylobacter spp., E. coli и Enterococcus spp. Дополнительно могут быть добавлены Staphylococcus spp., Clostridiales и Vibrio spp.
Руководство ФАО по исследованиям и мониторингу антибиотикорезистентности бактерий, выделяемых от здоровых продуктивных животных [12] (далее в тексте «Руководство ФАО») указывает порядок приоритета бактерий, выделяемых от животных и из продуктов питания, для включения их в программы мониторинга: (1) E. coli, (2) Salmonella spp., (3) Enterococcus faecium и Enterococcus faecalis, (4) Campylobacter spp.
В 2017 г. ВОЗ опубликовала список бактерий, для которых, в связи с распространением антибиотикорезистентности срочно требуется разработка новых антибиотиков [13] . Бактерии поделены на три категории — среднего, высокого и критического приоритета. Из зоонозных бактерий в группу высокого приоритета включили устойчивые к ванкомицину Enterococcus faecium, метициллин-резистентные и устойчивые к ванкомицину Staphylococcus aureus, устойчивые к фторхинолонам Campylobacter spp., устойчивые к фторхинолонам Salmonella spp.; в группу критического приоритета — устойчивые к карбапенемам и продуцирующие бета-лактамазы расширенного спектра (БЛРС) бактерии порядка Enterobacterales, включая E. coli и Salmonella spp.
Таким образом, все три международные организации — МЭБ, ВОЗ и ФАО едины во мнении, что приоритетными являются: E. coli, Salmonella spp., Campylobacter spp. и Enterococcus spp. Кроме того, может быть исследована устойчивость и других зоонозных бактерий, в частности, Listeria monocytogenes, Vibrio spp. (выделяют из водных животных), стафилококков, в особенности MRSA. Для идентификации MRSA требуются дополнительные предварительные исследования чувствительности.
В случае, если есть возможность включить только одну бактерию, оптимальным будет являться выбор E. coli. Приоритетные бактерии представлены в таблице 2.
Таблица 2. Информация о приоритетных бактериях, выделяемых от животных, для включения в программы мониторинга
| ПРИОРИТЕТНЫЕ БАКТЕРИИ | |
| Индикаторные (комменсальные) бактерии | |
| E. coli (наивысший приоритет) | Грамотрицательная бактерия |
| Enterococcus spp. | Грамположительные бактерии, рекомендуется идентификация до вида, приоритетные — Enterococcus faecalis и Enterococcus faecium |
| Зоонозные бактерии | |
| Salmonella spp. | Рекомендуется идентификация до серовара, поскольку от него зависит профиль устойчивости |
| Сampylobacter spp. | Рекомендуется идентификация до вида, приоритетные — Campylobacter jejuni и Campylobacter coli |
| ПРИМЕРЫ ДОПОЛНИТЕЛЬНЫХ ЗООНОЗНЫХ БАКТЕРИЙ | |
| Staphylococcus spp. | Рекомендуется идентификация до вида, приоритетный — Staphylococcus aureus |
| Listeria spp. | Рекомендуется идентификация до вида и исследования одного, наиболее актуального патогена — Listeria monocytogenes |
| Vibrio spp. | Рекомендуется идентификация до вида, приоритетные — Vibrio cholerae, Vibrio parahaemolyticus и Vibrio vulnificus |
4.2 Антимикробные препараты
Антимикробные препараты активно применяются в ветеринарии с целью лечения инфекционных заболеваний, их профилактики, а также стимуляции роста. Последние два вида использования наиболее опасны с точки зрения развития антибиотикорезистентности зоонозных бактерий. Приблизительно 70–80% от общего объёма антибактериальных средств, применяемых в медицине и ветеринарии, приходятся на ветеринарию. Из всех применяемых для животных антибактериальных препаратов, приблизительно 70% используются для терапии инфекционных заболеваний у человека.
Учитывая, что в ветеринарии и медицине активно применяется значительное количество антимикробных препаратов (несколько сотен), их выбор для включения в программу мониторинга антибиотикорезистентности является непростой задачей.
Для включения антимикробных препаратов в программу мониторинга могут быть предложены следующие критерии:
- Значимость для сектора общественного здравоохранения, наличие рекомендаций по минимизации применения в сельском хозяйстве.
- Значимость и интенсивность применения в ветеринарии.
- Наличие критериев интерпретации результатов определения чувствительности.
- Наличие стандартных образцов для работы и дисков для диско-диффузионного метода.
- Наличие данных об устойчивости/чувствительности к антимикробным препаратам из других отечественных, зарубежных и международных исследований.
4.2.1. Критерий значимости для сектора общественного здравоохранения и наличия рекомендаций по минимизации применения антибиотиков в животноводстве
ВОЗ составила список критически важных для медицины антимикробных препаратов. Последняя на сегодняшний день, 6-я версия документа была опубликована в 2019 г. [14] . В списке осуществлено ранжирование значимых для медицины антибиотиков по степени риска возникновения к ним устойчивости, связанным с их использованием для животных. Антимикробные препараты разделены на три группы: важные, особой важности и критически важные.
Европейское медицинское агентство (EMA, European Medicines Agency) провело категоризацию антибиотиков при их применении в животноводстве по критериям риска для здоровья человека и животных [15] .
EMA разделило антибиотики на 4 категории (таблица 3). В Российской Федерации НИИ Антимикробной химиотерапии (г. Смоленск) составило актуальный Перечень антибиотиков, рекомендованный для проведения эпидемиологического наблюдения за антибиотикорезистентностью приоритетных возбудителей заболеваний человека, указанный в разделе 3.5.3.2. Практического руководства по мониторингу антибиотикорезистентности с использованием платформы AMRcloud [16] . АМП указаны в соответствии с группами микроорганизмов, для которых следует определять чувствительность данного АМП (https://monitoring.amrcloud.net/docs/03/05 ).
Из зоонозных бактерий в список включены АМП, активные в отношении антибиотики против порядка Enterobacterales (куда входят E. coli и Salmonella spp.), Staphylococcus aureus, Enterococcus faecalis и Enteroccus faecium.
Таблица 3. Категории антибактериальных препаратов, применяемых в животноводстве по критериям риска для здоровья человека и животных
| Название категории | Описание категории |
|---|---|
| Категория А (Необходимо избегать применения) | Антибиотики, не зарегистрированные к применению в Евросоюзе для животных. |
| Категория В (Ограничить применения) | Критически важные для медицины антибиотики. Для продуктивных животных их следует использовать только для лечения и только в тех случаях, когда другие антибиотики неэффективны. В данную категорию отнесли фторхинолоны, цефалоспорины III–IV поколения и полимиксины (колистин). |
| Категория С (Использовать с осторожностью) | Антибиотики, которые следует применять только, если не будет эффективным использование антибиотиков из группы D. |
| Категория D | Антибиотики, представляющие наименьший риск. |
4.2.2. Критерий важности и интенсивности применения в ветеринарии
МЭБ составила список наиболее важных антибиотиков для ветеринарии, последняя на сегодняшний день версия которого была выпущена в 2021 г. [17] Также, как и в списке ВОЗ, антибиотики поделены на важные, особо важные и критически важные.
Список зарегистрированных в России антибиотиков для ветеринарного применения доступен в формате Excel в Государственном реестре лекарственных средств для ветеринарного применения [18] .
В таблице 4 приведены зарегистрированные в России антибиотики для продуктивных животных, включённые ВОЗ в группы критически важных и особо важных для сферы общественного здравоохранения [14] .
Россельхознадзор собирает с регионов сведения о применении антибактериальных средств в каждом хозяйстве. Информация находится в закрытом доступе, но для её получения может быть направлен запрос в Центральный аппарат Россельхознадзора.
В целом при составлении списка исследуемых антибиотиков можно рекомендовать гибкий подход, предполагающий включение с одной стороны важных для медицины антибиотиков, которые не зарегистрированы в нашей стране для продуктивных животных и не применяются в ветеринарии, (например, меропенема для кишечной палочки и ванкомицина для энтерококков), а с другой стороны напротив, антибиотиков, которые значительно более важны для ветеринарии, чем для медицины (например, кормовые антибиотики виргиниамицин и бацитрицин для энтерококков).
Таблица 4. Антибактериальные препараты, применяемые для продуктивных животных и представленные в списках ВОЗ как важные и особо важные для сферы общественного здравоохранения
| Класс антимикробных средств | Представители класса |
| Критически важные для медицины антибиотики | |
| Фторхинолоны* | Ципрофлоксацин, норфлоксацин, флумеквин, марбофлоксацин |
| Полимиксины | Колистин* |
| Цефалоспорины III и выше поколений* | Цефкином (IV поколение), цефподоксим (III поколение), цефотаксим (III поколение) |
| Аминогликозиды | Гентамицин, неомицин, канамицин |
| Анзамицины | Рифампицин |
| Макролиды | Азитромицин, эритромицин, спирамицин |
| Пенициллины | Ампициллин, амоксициллин, феноксиметилпенициллин, бензилпенициллин, клоксациллин |
| Особо важные для медицины антибиотики | |
| Амфениколы | Хлорамфеникол |
| Цефалексин, цефалоним, цефапирин | Ампициллин, амоксициллин, феноксиметилпенициллин, бензилпенициллин, клоксациллин |
| Тетрациклины | Тетрациклин, окситетрациклин, хлортетрациклин, доксициклин |
| Линкозамиды | Линкомицин, клиндамицин |
| Сульфаниламиды/диаминопиримидины | Сульфаметоксазол-триметоприм |
* — фторхинолоны, колистин и цефалопорины III–IV поколений рассматриваются международными организациями как наиболее важные для медицины антибиотики, на устойчивость к которым влияет их применение в животноводстве, соответственно, их можно рассматривать и как приоритетные для включения в программы исследования устойчивости.
4.2.3. Наличие критериев интерпретации
Данная составляющая планирования является критически важной, поскольку, если антибиотик важен для медицины и активно применяется в ветеринарии в России, это совсем не означает, что для него имеются международно признанные критерии интерпретации по определению чувствительности.
Критерий интерпретации — это табличное значение минимальной подавляющей концентрации — МПК (для метода серийных разведений) или диаметра зоны задержки роста (для диско-диффузионного метода), которое позволяет определить: будет ли исследуемый изолят отнесён к категории чувствительных или устойчивых к воздействию антибиотика.
Включение в программу исследований комбинаций «бактерия-антибиотик», для которой критерии интерпретации отсутствуют, имеет смысл только в том случае, если стоит цель накопить данные о распределении активности исследуемого АМП в отношении популяции конкретного вида микроорганизма (формирование популяционных распределений МПК и диаметров зон подавления роста).
Критерии интерпретации могут быть указаны для клинической и микробиологической устойчивости. Отличие микробиологической и клинической устойчивости рассмотрено в разделе 3.5.2. Практического руководства по мониторингу антибиотикорезистентности с использованием платформы AMRcloud [16] . Критерии интерпретации (точки отсечения) устанавливают в разных странах, при этом за основу берут критерии, разрабатываемые двумя организациями — Европейским комитетом по определению чувствительности к антимикробным средствам (European Committee of Antimicrobial Susceptibility Testing, EUCAST) и Институтом клинических и лабораторных стандартов США (Clinical and Laboratory Standards Institute, CLSI).
Обе организации устанавливают критерии чувствительности для микроорганизмов-возбудителей инфекционных заболеваний у человека (клинической устойчивости), при этом сами значения точек отсечения могут отличаться, совпадая, в целом, на 80–90%. EUCAST также определяет критерии микробиологической устойчивости, а CLSI — главным образом критерии клинической устойчивости для животных, как продуктивных, так и домашних. Ветеринарные критерии необходимы в первую очередь при исследовании патогенов животных.
Критерии устойчивости EUCAST доступны на официальном сайте EUCAST — микробиологической [19] и клинической устойчивости [20] .
Критерии клинической устойчивости CLSI, как медицинские, так и ветеринарные, доступны в соответствующих стандартах на официальной странице учреждения [21] .
Для основных клинически значимых возбудителей заболеваний у человека точки отсечения указаны в стандарте CLSI M100 ED32:2022 Performance Standards for Antimicrobial Susceptibility Testing, 32nd Edition (Стандарты проведения исследований на чувствительность к антимикробным препаратам, 32-е издание) [22] .
В Российской Федерации Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) публикует рекомендации по определению чувствительности бактерий к антибиотикам, которые содержат, в том числе точки отсечения. За основу предлагаемых МАКМАХ критериев взяты клинические точки отсечения EUCAST [23] .
Прежде, чем включить какой-либо антибиотик в программу исследований, необходимо удостовериться, что для него имеются критерии клинической, либо микробиологической устойчивости, либо обоих видов устойчивости — в зависимости от целей исследования.
Критерии интерпретации микробиологической и клинической устойчивости по версиям EUCAST и СLSI могут значительно различаться не только по значениям, но и по наличию. Для одних антибиотиков может присутствовать только микробиологическая точка отсечения, для других — только клиническая EUCAST или CLSI и т.д.
В случае, если исследования устойчивости бактерий к определённому антибиотику представляет особую важность, но точки отсечения отсутствуют, существует методология самостоятельного определения микробиологических точек отсечения. Критерии интерпретации и EUCAST, и СLSI подлежат ежегодному пересмотру, и нельзя исключить их изменения или даже исчезновения в более свежей версии стандартов. Поэтому при планировании исследования необходимо брать критерии из последней на данный момент версии стандартов.
В целом, перечень АМП, использующихся в ветеринарии и для которых доступны критерии интерпретации, ограничен.
Для упрощения процедуры планирования можно рекомендовать: составить таблицу, в которой для каждого их выбранных антибиотиков будут указано, какие критерии для него существуют.
4.2.4. Наличие стандартных образцов для работы и дисков для диско-диффузионного метода
При планировании исследований антибиотикорезистентности необходимо убедиться, что для выбранных антибиотиков на отечественном рынке доступны стандартные образцы достаточной химической чистоты для метода серийных разведений и диски с нанесёнными на них антибиотиками для диско-диффузионного метода.
4.2.5. Наличие для антимикробного средства данных мониторинга устойчивости
Данный критерий важен для того, чтобы иметь возможность сопоставить свои данные с данными мониторинга, проведённого другими отечественными и зарубежными организациями. Сравнение даёт более широкое поле для анализа собственных данных и выводов из них — как в научном аспекте, так и в практическом аспекте разработки управленческих мер.
Источники данных указаны в разделе 4 настоящего руководства «Системы мониторинга и источники данных об антибиотикорезистентности зоонозных и индикаторных бактерий, выделяемых от животных».
Из каждого класса целесообразно выбрать не более 1–2 антибиотиков. Если два антибиотика относятся к одному классу, то это должны быть антибиотики, устойчивость к которым формируется за счет различных механизмов, например, гентамицин и стрептомицин для E. coli. Напротив, не стоит брать антибиотики с перекрёстной устойчивостью, приближающейся к 100%, например ципрофлоксацин и энрофлоксацин для кишечной палочки. Если антибиотик применяют в комбинации с другим или с ингибитором разрушающих его ферментов, то их также целесообразно включать в программу.
По результатам анализа приведённых выше документов и списков, а также собственного опыта, можно предложить минимальный набор антибиотиков для тестирования приоритетных групп бактерий (таблица 5).
Таблица 5. Набор антибактериальных препаратов для тестирования приоритетных групп бактерий
| Группа антибактериальных средств | Примеры представителей группы, рекомендуемые для включения в программу |
| E. coli и Salmonella spp. | |
| Фторхинолоны | Ципрофлоксацин |
| Цефалоспорины III и выше поколений | Цефотаксим |
| Полимиксины | Колистин |
| Амфениколы | Хлорамфеникол |
| Пенициллины | Ампициллин |
| Тетрациклины | Тетрациклин |
| Сульфаниламиды | Сульфаметоксазол |
| Сульфаниламиды/Триаминопиримидины | Триметоприм/сульфаметоксазол |
| Аминогликозиды | Гентамицин |
| Карбапенемы | Меропенем |
| Enterococcus faecalis и Enterococcus faecium | |
| Пенициллины | Ампициллин |
| Амфениколы | Хлорамфеникол |
| Фторхинолоны | Ципрофлоксацин |
| Макролиды | Эритромицин |
| Аминогликозиды | Гентамицин |
| Тетрациклины | Тетрациклин |
| Гликопептиды | Ванкомицин |
| Кормовые антибиотики | Бацитрацин, вирджиниамицин |
| Campylobacter jejuni и Campylobacter coli | |
| Фторхинолоны | Ципрофлоксацин |
| Макролиды | Эритромицин |
| Аминогликозиды | Гентамицин, стрептомицин |
| Тетрациклины | Тетрациклин |
4.3 Виды и категории животных
Для выбора животных, от которых будут отбирать пробы биоматериала или соответствующего пищевого сырья, необходимо определить, какие из них несут наибольший риск передачи устойчивых бактерий человеку.
Это связано в первую очередь с объёмами потребления мяса и субпродуктов того или иного вида животных в исследуемой стране/регионе, отличиями в профилях устойчивости бактерий от разных видов животных, являющихся прямым следствием характера применения для них антибиотиков.
Если планируется исследование E.coli от животных с отбором проб по всей территории России, то целесообразно будет включить в программу образцы от птицы.
Птица — наиболее активно употребляемое в пищу населением России мясо. Устойчивость E.coli, выделенной от птицы, как правило, выше, чем от других животных — свиней, коров и т.д. Это связано с активным применением антибиотиков в птицеводстве с профилактическими целями. Без антибиотиков цыплят бройлеров в крупных птицеводческих хозяйствах не выращивают.
Планирование должно учитывать и региональную специфику. Так, если программа предназначена для какого-либо региона крайнего севера, то целесообразно включить в неё образцы от северных оленей.
Отбор проб от разных видов животных позволяет получить более полные и пригодные данные для разработки управленческих мер.
Приоритетными для России могут быть названы три вида животных: куры, коровы и свиньи.
При планировании и отборе проб также необходимо учитывать категорию животных, например, мясной или молочный КРС, взрослые свиньи или поросята, поскольку для разных категорий животных устойчивость может отличаться.
4.4 Тип образца
Отбираемые образцы можно разделить на три типа: биоматериал животных, объекты внешней среды и сырьё животного происхождения.
Биоматериал:
- фекалии;
- части кишечника;
- смывы с тушек;
- тушки.
Объекты внешней среды:
- смывы с поверхностей помещения, где содержатся животные;
- конвеерные ленты и другое оборудование;
- подстилка;
- вода из поилок.
Если для сравнения проводятся исследования бактерий из входящего материала, то может быть взята чистая подстилка, корм.
Сырьё животного происхождения:
- мясо;
- субпродукты;
- яйца;
- молоко;
- рыба.
Образцы биоматериала от животных могут быть отобраны непосредственно в хозяйстве или в убойном пункте. Образцы сырья животного происхождения — в убойном пункте или в торговой точке.
Согласно Руководству ФАО [12] , оптимальным является отбор проб в конце производственного цикла, т.е. на убойном пункте, за исключением кур-несушек и молочного КРС. Отбор мяса/субпродуктов из торговых точек рассматривается скорее как дополнительная опция.
Образцы необходимо отбирать от здоровых, без признаков болезней, животных, поскольку заболевшие животные, как правило, подвергаются воздействию антибиотиков, и выделенные из них бактерии имеют более высокий риск развития устойчивости. Отбор проб следует производить от случайно выбранных животных или групп животных с целью получения репрезентативных данных.
Пробы могут быть отобраны как от отдельных животных, так и в виде сборной пробы.
Предпочтительным является отбор проб от отдельных животных. У млекопитающих и птицы могут быть взяты мазки из прямой кишки/клоаки — как от живых животных, так и после убоя.
Руководство ФАО [12] рекомендует отбор на убойном пункте целиком слепой кишки (цекума). Цекум позволяет получить более точные данные по устойчивости, отражающие характер применения антибиотиков в хозяйстве, чем клоакальные/ректальные мазки, поскольку для последних двух типов проб выше вероятность контаминации посторонними бактериями — от людей и т.д.
В случае отбора сборной пробы фекалий в птичнике может быть использована технология Boot Swab («Обувной тампон»), которая заключается в том, что смоченный пептонной водой одноразовый тампон наклеивают на подошву обуви, проходят по птичнику, снимают тампон с обуви вместе с налипшими фекалиями и помещают в стерильный контейнер. По сути, данный образец является подстилкой, т.е. объектом внешней среды.
Сборные пробы фекалий из коровника и свинарника можно отбирать с пола, в разных местах, стараясь, по возможности, набрать в пробирку материал из глубины кучи помёта, который не контактировал с поверхностями и воздухом.
Для объектов внешней среды ещё выше, чем для ректальных/клоакальных мазков и фекалий вероятность того, что выделенные из них бактерии будут иметь происхождение от людей и из окружающей среды, а не от животных. То же относится и к образцам пищевого сырья животного происхождения.
При этом, в зависимости от целей исследований, может быть рациональным отбор именно объектов внешней среды и пищевого сырья.
Если есть необходимость исследовать изоляты именно от животных, чтобы оценить влияние применения антибиотиков в хозяйстве на уровни устойчивости, предпочтительным является цекум или клоакальный/ректальный мазок. Когда стоит задача исследования штаммов, циркулирующих в хозяйстве, как от людей, так и от животных, то лучшее представление будет получено при исследовании объектов внешней среды. Если задача — определить профиль устойчивости бактерий на конечном этапе производства и реализации, т.е. непосредственно тех бактерий, которые могут заразить людей при употреблении в пищу мяса и др. продукции, то целесообразен отбор пищевого сырья.
Таблица 6. Рекомендации по виду животных и типам образца
| Параметр | Приоритеты |
|---|---|
| Состояние животных | Строго здоровые животные, без признаков бактериальных заболеваний |
| Виды животных | Птица (курица), корова, свинья |
| Категория животных | Для кур — цыплята-бройлеры, для свиней и коров — взрослые животные на заключительном этапе откорма |
| Места отбора проб | Убойный пункт |
| Тип образца | Цекум, ректальный/клоакальный мазок, фекалии |
Таблица 7. Рекомендации по месту отбора проб и типам образца из Руководства ФАО
| Животные | Место отбора проб | Виды бактерий и типы образцов | |||||
|
Salmonella spp. |
E. coli |
C. coli |
C. jejuni |
E. faecium |
E. faecalis |
||
| Куры-бройлеры | Хозяйство | Обувной тампон | |||||
| Куры-бройлеры | Убойный пункт | Цекум | Цекум | Цекум | Цекум | Цекум | Цекум |
| Куры-несушки | Хозяйство | Обувной тампон | |||||
| Свиньи | Убойный пункт | Цекум/ректальный мазок | Цекум | Цекум | Цекум | Цекум | |
| КРС | Убойный пункт | Цекум/ректальный мазок | Цекум | Цекум | Цекум | ||
| Мясо бройлеров | Убойный пункт, роз- ничная торговая точка | Кожа | Кожа | Кожа | |||
| Свинина | Убойный пункт, роз- ничная торговая точка | Мясо | Мясо | Мясо | Мясо | Мясо | |
| Говядина | Убойный пункт, роз- ничная торговая точка | Мясо | Мясо | Мясо | Мясо | ||
4.5 Планирование отбора образцов
При оптимальном варианте программа исследований антибиотикорезистентности охватывает до 80% поголовья животных в исследуемой стране/регионе. Отбор образцов должен быть репрезентативным и случайным. При этом может учитывать ожидаемые уровни устойчивости (т.е. доли устойчивых изолятов) и требуемую статистическую значимость.
Приложение 1 Руководства ФАО [12] содержит формулу для расчёта необходимого количества изолятов:

Если величина ожидаемой распространённости неизвестна, то её, как правило, берут равной 50%, поскольку при этом потребуется анализ максимального количества изолятов. В этом случае при 95% доверительной интервале и прогрешности в 5% требуемое количество образцов будет равным:
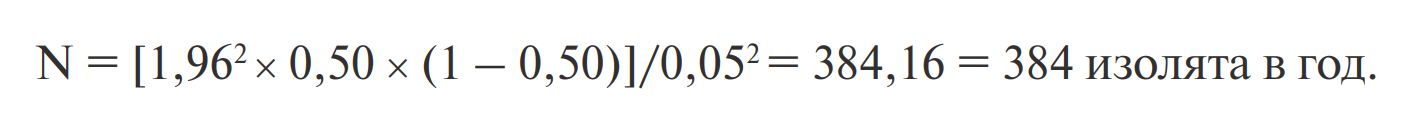
Для расчёта требуемого количества изолятов могут быть использованы специальные программы, доступные в интернете:
- Select Statistics Population Proportion — Sample Size calculator: https://select-statistics.co.uk/calculators/sample-size-calculatorpopulation-proportion/
- Open Epi: http://www.openepi.com/SampleSize/SSPropor.htm
Данные программы позволяют также выбирать значение параметра поголовья животных.
Указанная методика расчёта количества изолятов необходима только для широкомасштабных исследований, на уровне всей страны или, как минимум, региона. В отчётах и научных публикациях не встречалось упоминаний о её применении.
В целом, при определении количества изолятов в исследованиях устойчивости любого масштаба следует руководствоваться принципом, изложенных в разделе 6.8.4. Кодекса здоровья наземных животных МЭБ «Количество образцов должно быть достаточно большим для обнаружения либо выявления уровней или трендов имеющейся или прогнозируемой фенотипической устойчивости».
При определении количества образцов необходимо учесть вероятность выделения из образца изолята требуемой бактерии. Например, для E. coli он гипотетически может быть близок к 100%, для E. faecalis и E. faecium — 80%, Salmonella spp. — 40%, Campylobacter spp. — 10%. На кампилобактерии в этом плане следует обратить особое внимание, т.к. вероятность их выделения из образца относительно невысока. Таким образом, планируемое количество проб следует скорректировать на вероятность получения из них изолятов.
При отборе образцов все доступные места следует разделить на эпидемиологические единицы. Считается, что профиль устойчивости бактерий одного вида (энтерококки, кампилобактерии и E. coli) или одного серовара (Salmonella spp.), выделенных из образцов, отобранных в одной и той же эпидемиологической единице, будет в значительной степени схожим, поскольку животные находятся в одинаковых условиях, в том числе в аспекте применения антибиотиков. Для свиней на откорме и КРС эпидемиологической единицей является всё стадо в хозяйстве.
Для цыплят-бройлеров — изолированное поголовье, т.е. птица, выращиваемая в одних и тех же условиях, в одном и том же помещении. В крупных птицеводческих хозяйствах эпидемиологической единицей можно считать цех.
При проведении масштабных исследований, включающих в себя большое количество хозяйств (начиная от нескольких десятков), количество изолятов из одной эпидемиологической единицы необходимо минимизировать, в идеале оно должно быть равным 1. Значительное количество изолятов из одного хозяйства может привести к противоречивым результатам и запутать исследователей. Таким образом, предпочтительнее выделить меньше изолятов из большего количества хозяйств, чем наоборот. Если планируются исследования на постоянной основе, т.е. мониторинг, то для изучения временной динамики антибиотикорезистентности образцы из одной и той же эпидемиологической единицы следует отбирать раз в год, при этом желательно, чтобы месяц отбора проб каждый год совпадал. Рекомендации по планированию отбора образцов резюмированы в таблице 8.
Таблица 8. Рекомендации по месту отбора проб и типам образца из Руководства ФАО
| Параметр | Рекомендация |
|---|---|
| Планируемое количество образцов | Количество проб должно быть достаточным для выявления уровней и трендов устойчивости. При масштабных исследованиях возможно использование формул для расчёта образцов, учитывающих ожидаемый уровень устойчивости, необходимую погрешность и доверительный интервал. |
| Вероятность выделения изолята из пробы | Количество образцов необходимо скорректировать с учётом данного показателя. Низкая вероятность выделения изолята из образца требует отбора большего количества образцов, что особенно актуально для кампилобактерий. |
| Количество изолятов из одного хозяйства | Общее правило — больше хозяйств, меньше изолятов из одного хозяйства. В идеале, в птицеводческих хозяйствах следует отбирать количество образцов, необходимое для выделения одного изолята на каждый цех птицеводческого хозяйства. Для свиноводческих предприятий и предприятий по выращиванию КРС — количество образцов, необходимое для получения одного изолята на хозяйство. |
| Отбор образцов при мониторинге, для изучения временных трендов | Необходимо отбирать образцы в одной и той же эпидемиологической единице один раз в год, желательно в один и тот же месяц. |
4.6 Отбор, маркировка, хранение и транспортировка образцов
4.6.1. Отбор образцов
Отбор образцов должен производиться в асептических условиях, со всеми необходимыми мерами биологической безопасности, сотрудниками, имеющими соответствующую квалификацию и опыт.
Слепую кишку от птицы на убойном пункте лучше всего отбирать в течение 10 минут после убоя, следя за тем, чтобы она была интактной и наполненной.
Согласно принципу репрезентативности и случайности, образцы следует отбирать от разных партий птицы. Одной партией можно считать птицу, которая находилась вместе в одном хозяйстве и подвергалась одинаковому воздействию антибиотиков. Допускается создание сборной пробы нескольких цекумов от разных птиц из одной партии. Цекумы помещают в стерильный специальный пакет или контейнер для отправки в лабораторию. На убойном пункте могут быть отобраны также целые тушки птицы или с них могут быть сделаны смывы.
Данные рекомендации подходят и для отбора цекумов от млекопитающих. Отбор образцов производится от разных партий животных из разных эпидемиологических единиц (поголовье животных в одном хозяйстве).
При отсутствии возможности отобрать цекум, асептическим образом могут быть взяты фекалии из кишечника после убоя животного.
В хозяйствах могут быть произведены клоакальные/ректальные мазки, отбор фекалий и объектов внешней среды.
4.6.2. Маркировка
Помещённый в стерильный контейнер/пакет образец следует промаркировать, указав сведения о нём как можно более полно и достоверно.
Рекомендации сведений об образце, которые необходимо собрать:
- Сотрудник, осуществивший отбор, его контактные данные
- Дата и время отбора образца
- Тип хозяйства/убойного пункта
- Точное местонахождение хозяйства/убойного пункта, в идеале с географическими координатами
- Размер поголовья в хозяйстве/пропускная способность убойного пункта
- Сведения о применении в хозяйстве антибиотиков, в идеале — с указанием названия препаратов, длительности применения, количества пролеченных животных
- Сведения о животном (вид, категория, возраст, пол, порода, состояние, применение антибиотиков для данного животного)
- Индивидуальная или сборная проба
- Условия транспортировки образца, в частности, использование транспортной среды
4.6.3. Транспортировка и хранение образцов
Образцы в стерильных пакетах или контейнерах необходимо транспортировать при температуре не выше 10°С, но не допуская замораживания. Для этого могут быть использованы транспортные термокороба с помещёнными внутрь солевыми хладоэлементами (аккумуляторами холода).
Образцы необходимо транспортировать способом, исключающим обмен бактерий между ними и окружающей средой и попаданием материала одного образца в другой.
Необходимо соблюдать принцип тройной упаковки проб:
- Внутренняя упаковка — влагонепроницаемая и герметичная.
- Средняя упаковка — прочная, влагонепроницаемая и герметичная.
- Внешняя упаковка — твёрдая, защищающая образцы от механического воздействия.
Образцы следует доставить в лабораторию немедленно, лучше в срок до 24 часов и сразу отправить в работу. Если это невозможно, допускается хранение при 3–7°С в течение 72-х часов после отбора.
Campylobacter spp. особенно чувствительны к внешнему воздействию, включающему дегидратацию, прямые солнечные лучи, кислород, повышенные температуры. Поэтому для них правило немедленной доставки в лабораторию особенно актуально, следует избегать воздействия указанных факторов, температуры выше 20°С и перепадов температуры. Если время между отбором образца на кампилобактерии и началом работы с ним превышает 48 ч., хранить его рекомендуется при температуре 4 ± 2°С.
5. Выделение и идентификация бактерий
При выделении бактерий из образцов следует руководствоваться правилом: один образец = один изолят. Большее количество изолятов из одного образца нецелесообразно, т.к. приведёт только к дополнительной путанице в данных, как и в случае с большим количеством изолятов из одного хозяйства.
5.1 Методы выделения и идентификации Escherichia coli
Исследования проводят руководствуясь, ГОСТ 30726–2001 «Продукты пищевые. Методы выявления и определения количества бактерий вида Escherichia coli», ГОСТ 32011–2013 (ISO 16654:2001) «Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод обнаружения Escherichia coli О157», МУК 4.2.2963–11 «Методические указания по лабораторной диагностике заболеваний, вызываемых Escherichia coli, продуцирующих шига-токсины (STEC-культуры), и обнаружению возбудителей STEC-инфекций в пищевых продуктах», ГОСТ 31708–2012 (ISO 7251:2005) «Микробиология пищевых продуктов и кормов. Метод обнаружения и определения количества презумптивных бактерий Escherichia coli. Метод наиболее вероятного числа», ГОСТ 31878–2012 «Корма для животных. Метод обнаружения и подсчета бактерий группы кишечных палочек (колиформных бактерий). Метод наиболее вероятного числа», ГОСТ 31747–2012 «Продукты пищевые. Методы выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий)», ГОСТ Р 54374–2011 «Мясо птицы, субпродукты и полуфабрикаты из мяса птицы. Методы выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий)», «Методические указания по лабораторной диагностике колибактериоза (эшерихиоза) сельскохозяйственных животных», утв. ГУВ МСХ и П РБ 17.12.2007 (№ 10–25/1118).
Идентификацию выделенных культур проводят с помощью доступных коммерческих биохимических тест-системы, также может быть использован MALDI-TOF MS.
5.2 Метод выделения и идентификации Salmonella spp.
Исследования проводят, руководствуясь МУ 4.2.2723–10 «Лабораторная диагностика сальмонеллезов, обнаружение сальмонелл в пищевых продуктах и объектах окружающей среды», ГОСТ 31468–2012 «Мясо птицы, субпродукты и полуфабрикаты из мяса птицы. Метод выявления сальмонелл», ГОСТ Р 50455–92 (ISO 3565–75) «Мясо и мясные продукты. Обнаружение сальмонелл (арбитражный метод)», ГОСТ 31659–2012 (ISO 6579:2002) «Продукты пищевые. Метод выявления бактерий рода Salmonella».
Идентификацию полученных чистых культур микроорганизмов проводят с помощью доступных биохимических тест-систем, а также MALDI-TOF MS.
5.3 Метод выделения и идентификации Campylobacter spp.
Исследования проводят, руководствуясь ГОСТ ISO 10272–1-2013 «Микробиология пищевых продуктов и кормов для животных. Методы обнаружения и подсчета бактерий Campylobacter spp. Часть 1. Метод обнаружения», МУК 4.2.2321–08 «Методы определения бактерий рода Campylobacter в пищевых продуктах». «Методические указания по лабораторной диагностике кампилобактериоза (вибриоза) сельскохозяйственныхживотных», утв. ГУВМСХиПРБ17.06.2008 (№10–1-5/613), МУ «Идентификация микроорганизмов с применением масс-спектрометра Maldi Biotyper microflex при исследовании продовольственного сырья и пищевых продуктов».
Первичные посевы испытуемых проб проводят на обогатительный бульон Болтона. Далее пересевают на селективные среды (агар mCCD, модифицированную среду Мюллер-Хинтона, агар Престона). Инкубирование проводят в микроаэрофильных условиях при температуре 37°С в течение (44±4) ч.
При обнаружении культур, характерных для кампилобактерий, вид Campylobacter идентифицируют с помощью доступных коммерческих биохимических тест-систем и MALDI-TOF MS.
5.4 Метод выделения и идентификации Enterococcus spp.
Исследования проводят руководствуясь, ГОСТ 28566–90 (СТ СЭВ 6646–89) «Продукты пищевые. Метод выявления и определения количества энтерококков», ГОСТ Р 54354–2011 «Мясо и мясные продукты. Общие требования и методы микробиологического анализа», «Методические указания по лабораторной диагностике стрептококкоза животных и птиц», утв. ГУВ МСХ и П РБ 17.12.2007 (№ 10-25/1129).
Идентификацию выделенных культур проводят с помощью доступных коммерческих биохимических тест-систем, а также MALDI-TOF MS.
Методология выделении бактерий представлена также в Руководстве ФАО [12] .
6. Определение чувствительности бактерий к антибиотикам
Определение чувствительности бактерий к антибиотикам следует проводить в соответствии с Рекомендациями МАКМАХ «Определение чувствительности микроорганизмов к антимикробным препаратам (2021)», составленными на основе стандартов EUCAST [23] , либо в соответствии с международно гармонизированными протоколами EUCAST или CLSI.
Протоколы EUCAST полностью гармонизированы с международными стандартами ISO [24] [25] .
В большинстве случаев протоколы EUCAST и СLSI совпадают, однако для некоторых привередливых микроорганизмов имеются расхождения, например, в составе среды для кампилобактерий.
Предпочтительным является метод серийных разведений, поскольку он позволяет получить численное значение минимальной подавляющей концентрации.
6.1 Выбор разведений при постановке метода серийных разведений и контроль качества
При подготовке к постановке метода серийный разведений в бульоне встаёт вопрос: сколько лунок и с какими концентрациями антибиотиков запланировать для опытных изолятов каждой бактерии? Разведения антибиотика должны быть выбраны таким образом, чтобы с высокой вероятностью обнаружить концентрацию, соответствующую МПК, иначе опыт придётся переделывать, пока нужные разведения не будут подобраны эмпирически.
Перечень концентраций, которые определяются заранее с целью определить МПК всех опытных изолятов и контрольных штаммов называют диапазоном рабочих концентраций.
При выборе диапазона рабочих концентраций необходимо учитывать контрольные диапазоны, микробиологические и клинические точки отсечения.
Контрольный диапазон — это табличное значение диапазона МПК для контрольного штамма. Контрольный штамм — это штамм дикого типа, не обладающий приобретённой устойчивостью к тем антибиотикам, для контроля исследования, которых он предназначен.
Постановку контрольного штамма необходимо ставить в каждой серии с опытными образцами. Контрольные штаммы, предусмотренные международными стандартами методов определения чувствительности к антибиотикам (EUCAST и СLSI) — имеют порядковый номер коллекции ATCC (Американской коллекции типовых культур). Заказать их можно через различных зарубежных и отечественных поставщиков, также ряд отечественных медицинских и ветеринарных научных учреждений имеют эти контрольные штаммы в своих коллекциях с возможностью передачи. Если полученное для контрольного штамма в ходе эксперимента значение МПК находится в пределах контрольного диапазона, то результаты для опытных изолятов, поставленных в той же серии, можно считать валидными.
Если полученные для контрольного штамма значения МПК выходят за пределы контрольного диапазона, то опыт необходимо переделать. Возможно, проблема в том, что концентрация антибиотика не соответствует требуемой (например, ошибка в разведении, некачественный стандарт с содержанием антибиотика ниже заявленного).
Если концентрация антибиотика в реальности ниже ожидаемой, то полученное для контрольного штамма МПК будет смещено вправо относительно диапазона, т.е. превысит его верхний предел.
В целом, для контроля качества приоритетных групп бактерий оптимальной может быть признаны следующие положения:
- Для E. coli и сальмонелл в каждой серии ставят контроли для всех антибиотиков со штаммом E. coli ATCC 25922.
- Если для E. coli ATCC 25922 какого-то антибиотика нет, то следует брать в этом случае штамм Enterococcus faecalis ATCC 29212 так, чтобы для каждого антибиотика в каждой серии обязательно был контроль. В результате, для многих антибиотиков качество результатов будет проверено сразу по двум контрольным штаммам.
- Для энтерококков используют штамм Enterococcus faecalis ATCC 29212.
- Стрептомицин, сульфадиазин, сульфаметоксазол, эритромицин и др. можно ставить без контролей (поскольку для Enterococcus faecalis ATCC 29212 и E. coli ATCC 25922 контрольные значения отсутствуют).
- Для кампилобактерий используют штамм Campylobacter jejuni ATCC 33560, а для антибиотиков не имеющих допустимых диапазонов для данного штамма, можно поступать как со стрептомицином, сульфадиазином и сульфаметоксазолом — ставить эксперимент без контроля.
Более подробно порядок проведения контроля качества изложен в Рекомендациях МАКМАХ «Определение чувствительности микроорганизмов к антимикробным препаратам (2021)».
Существует также дополнительный инструмент контроля полученных данных — построение графика распределения МПК и сравнение его с табличными значениями EUCAST. Данный инструмент особенно актуален для антибиотиков, для которых отсутствуют контрольные диапазоны.
На графике распределения МПК по оси абсцисс отложены все значения МПК, зафиксированные для исследованных изолятов, а по оси ординат — доля изолятов с данным МПК среди общего количества изолятов. Зелёным или синим цветом на графике, как правило, обозначают столбцы чувствительных изолятов, МПК которых ниже точки отсечения, жёлтым — чувствительных при увеличенной экспозиции, красным — устойчивых.
Графики распределения МПК, полученные EUCAST, доступны на официальном сайте организации [19] .
Для примера на рисунке 1 представлен график распределения МПК тетрациклина для E. coli.
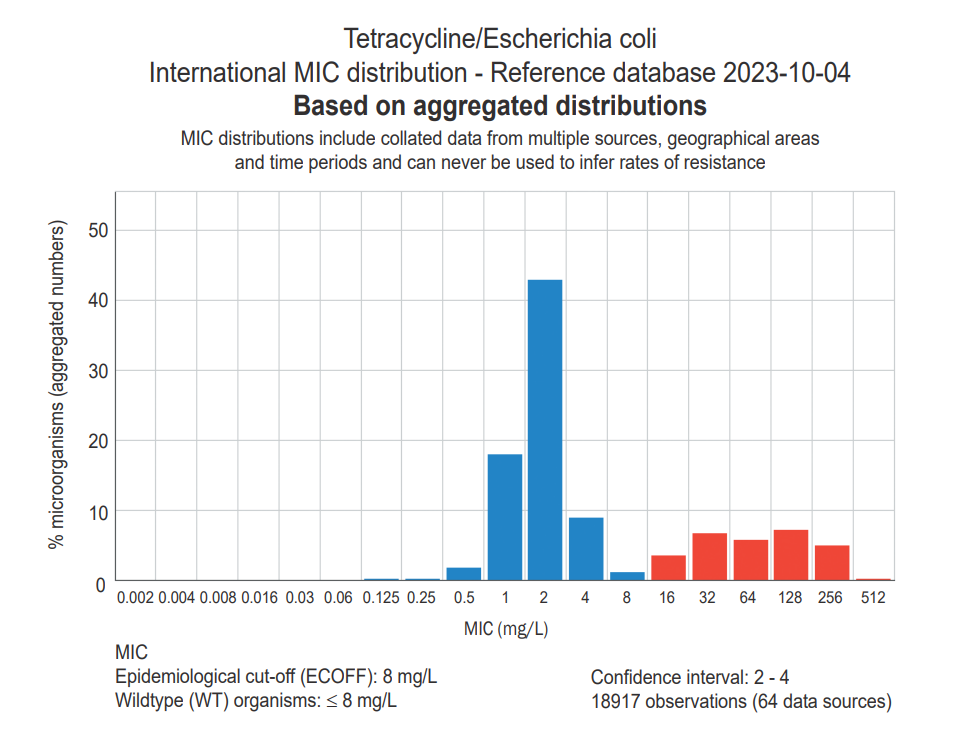
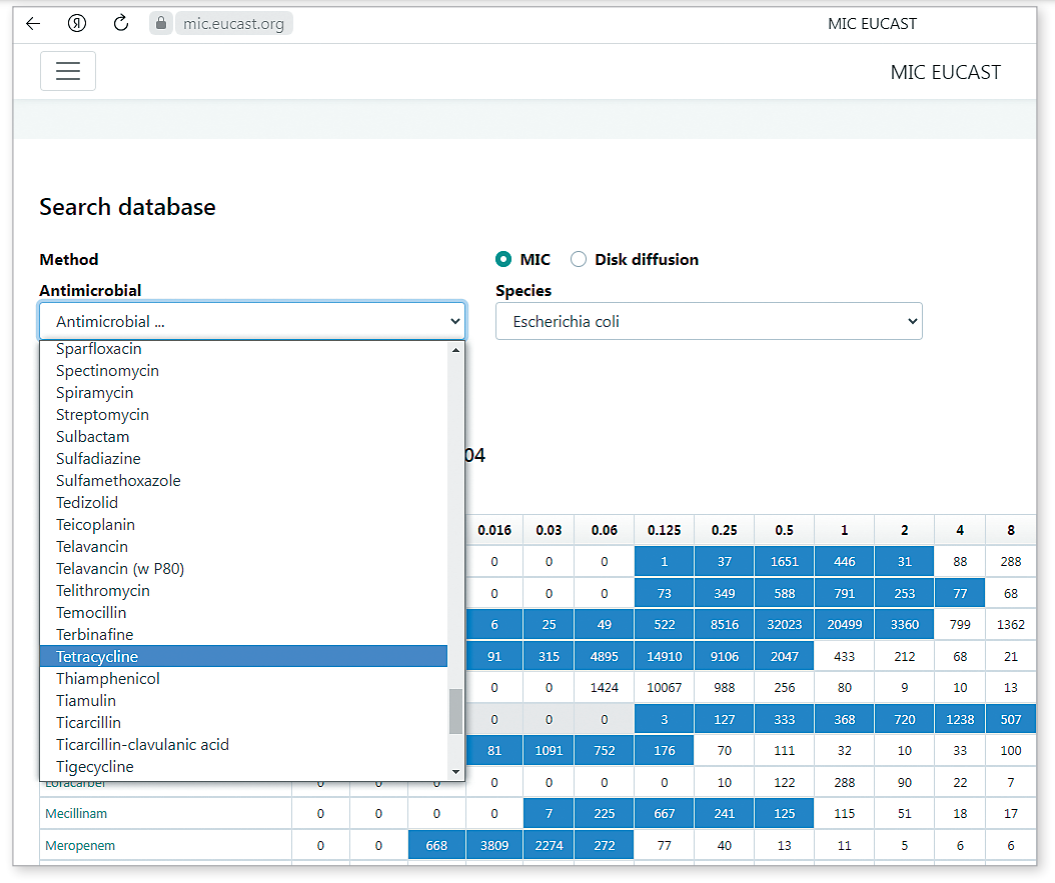
Чтобы увидеть график распределения, необходимо зайти в базу данных «MIC Distributions and ECOFFs» (Распределение МПК и микробиологические точки отсечения), выбрать бактерию и нажать на антибиотик из списка, либо, наоборот, выбрать антибиотик и нажать на бактерию. В таблице указано количество изолятов и на графике, которые были происследованы для его получения.Внешний вид базы представлен на рисунке 2.
Система AMRcloud позволяет легко строить график распределения МПК для комбинаций «бактерия-антибиотик», исследованных в рамках программы AMRcloud (см. раздел 5 «Использование платформы AMRcloud в мониторинге антибиотикорезистентности» Руководства по мониторингу с AMRcloud, 5.3. Углублённый анализ данных, 5.3.1.3 Подвкладка «МПК») [16] .
- Если пики на табличном (с сайта EUCAST) и опытном графике совпадают, это является дополнительным подтверждением валидности результатов.
- Если у опытного графика заметен явный сдвиг относительно табличного — на одну или несколько концентраций, это может свидетельствовать о проблемах, возникших при постановке опыта.
После установления контрольных диапазонов выбирают тестируемые концентрации антибиотиков.
Далее при определении диапазона рабочих концентраций необходимо учесть:
- Точки отсечения микробиологической устойчивости (ECOFF).
- Точки отсечения клинической устойчивости по системе EUCAST.
- Точки отсечения клинической устойчивости по системе CLSI.
Значения из таблиц МАКМАХ, EUCAST и СLSI интерпретируют следующим образом (Х — значение МПК опытного штамма, Min — минимальное значение, Maх — максимальное):
- Микробиологическая устойчивость:
- Если А ≤ Min, то изолят относится к категории S (чувствительный), если А > Min, то к категории — R (устойчивый).
- Клиническая устойчивость по критериям EUCAST/МАКМАХ:
- Если А ≤ Min, то изолят относится к категории S (чувствительный), если А > Min и А ≤ Max, то к категории «I» (ранее «промежуточно устойчивый», в настоящее время — «чувствительный при увеличенной экспозиции»), если А > Max, то к категории — R (устойчивый).
- Клиническая устойчивость по критериям CLSI:
- Если А ≤ Min, то изолят относится к категории S (чувствительный), если А > Min и А < Max, то к категории «I» (промежуточно устойчивый), если А ≥ Max, то к категории — R (устойчивый).
При определении рабочего диапазона концентраций следует руководствоваться правилом:
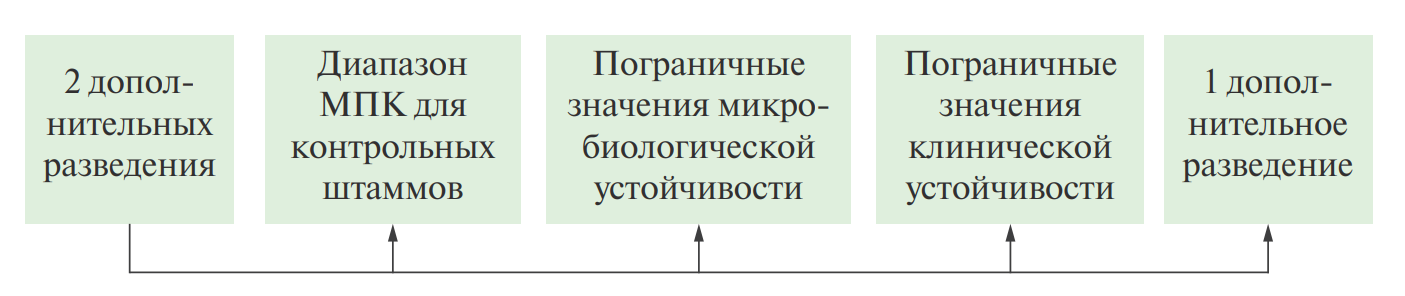
Например: если для бактерии А и антибиотика Б диапазон МПК для контрольных штаммов составляет 2–4 мг/л, значение микробилогической точки отсечения составляет — 8 мг/л, а клинической — 16 мг/л, то в данном случае, согласно указанному выше правилу, следует выбрать следующие тестируемые концентрации: 0,5–1-2–4-8–16-32 мг/л.
Диапазоны концентраций антибиотиков для некоторых приоритетных бактерий представлены в таблице 10.
Диапазон рабочих концентраций для контрольного штамма может быть уже, чем диапазон концентраций для опытных изолятов и составлен только с использованием контрольного диапазона руководствуясь правилом:

Например, для ципрофлоксацина и штамма E. coli ATCC 25922 он составит: 0,001–0,002–0,004–0,008–0,016–0,03
Накопив достаточно данных по опытным изолятам и определив, в каких пределах может оказаться их МПК, диапазон рабочих концентраций необходимо, насколько это возможно, сузить с целью экономии места на планшетах и других ресурсов.
Интерпретацию результатов определения чувствительности можно проводить вручную или автоматически. При этом оптимальным является второй вариант, поскольку он способствует минимизации ошибок и повышения качества микробиологического заключения.
В таком случае важно применять специализированное программное обеспечение с обязательными компонентами:
- автоматическая интерпретация количественных результатов определения чувствительности (определение категории чувствительности) согласно актуальным критериям;
- автоматический анализ полученного фенотипа резистентности/чувствительности микроорганизма и формирование дополнительных комментариев по результатам анализа.
Таблица 10. Примеры диапазонов концентраций антибиотиков в отношении приоритетных бактерий
| Антибиотик | Контрольный диапазон [23] , мг/л | Микробиологи ческая точка от сечения [19] , мг/л | Клиническая точка отсече ния EUCAST 2022 [20] , мг/л | Клиническая точка отсечения CLSI 2022 [22] , мг/л | Выбранные диапазо ны рабочих концентраций антибиотика в ячейках для опытных изолятов, мг/л |
| E. coli и Salmonella spp. контрольный штамм — E. coli ATCC 25922) | |||||
| Ципрофлоксацин | 0,004–0,016 | E. coli — 0,06S. enterica — 0,125 | S ≤ 0,25, R > 0,5Salmonella spp.: S ≤ 0,06, R > 0,06 | S ≤ 0,25, I = 0,5, R ≥ 1 (только E. coli) | 0,001–0,002–0,004–0,008–0,016–0,03–0,06–0,125–0,25–0,5–1–2 |
| Цефотаксим | 0,03–0,125 | E. coli — 0,25S. enterica — 0,5 | S ≤ 1, R > 2 | S ≤ 1, I = 2, R ≥ 4 | 0,001–0,002–0,004–0,008–0,016–0,03–0,06–0,125–0,25–0,5–1–2–4–8 |
| Колистин | 0,25–2 | E. coli — 2S. dublin — 16 | S ≤ 2, R > 2 | I ≤ 2, R ≥ 4 | 0,06–0,125–0,25–0,5–1–2–4–8 |
| Хлорамфеникол | 2–8 | 16 | S ≤ 8, R > 8 | S ≤ 8, I = 16, R ≥ 32 | 0,5–1–2–4–8–16–32–64 |
| Ампициллин | 2–8 | E. coli — 8S. enterica — 4 | S ≤ 8, R > 8 | S ≤ 8, I = 16, R ≥ 32 | 0,5–1–2–4–8–16–32–64 |
| Тетрациклин | 0,5–2 | 8 | - | S ≤ 4, I = 8, R ≥ 16 | 0,125–0,25–0,5–1–2–4–8–16–32 |
| Сульфаметоксазол | - | - | - | S ≤ 256, R ≥ 512 | 64–128–256–512–1024 |
| Триметоприм/сульфаметоксазол | ≤ 0,5 | E. coli — 0,5 | S ≤ 2, R > 4 | S ≤ 2/38, R ≥ 4/76 | 0,125/2,4–0,25/4,8–0,5/9,5–1/19–2/38–4/76–8/152 |
| Гентамицин | 0,25–1 | 2 | S ≤ 2, R > 2 | S ≤ 4, I = 8, R ≥ 16 | 0,06–0,125–0,25–0,5–1–2–4–8–16–32 |
| Меропенем | 0,008–0,06 | E. coli — 0,06 | S ≤ 2, R > 8 | S ≤ 1, I = 2, R ≥ 4 | 0,002–0,004–0,008–0,016–0,03–0,06–0,125–0,25–0,5–1–2–4–8 |
| Enterococcus faecalis и Enterococcus faecium (Контрольный штамм — Enterococcus faecalis ATCC 29212) | |||||
| Ампициллин | 0,5–2 | E. faecalis — 4E. faecium — 8 | S ≤ 4, R > 8 | S ≤ 8, R ≥ 16 | 0,125–0,25–0,5–1–2–4–8–16–32 |
| Хлорамфеникол | 2–8 (E. coli ATCC 25922) | 32 | - | S ≤ 8, I = 16, R ≥ 32 | 0,5–1–2–4–8–16–32–64 |
| Ципрофлоксацин | 0,5–2 | E. faecalis — 4E. faecium — 8 | S ≤ 4, R > 4 | S ≤ 1, I = 2, R ≥ 4 | 0,125–0,25–0,5–1–2–4–8 |
| Эритромицин | - | 4 | - | S ≤ 0,5, I = 1–4, R ≥ 8 | 1–2–4–8–16 |
| Гентамицин | 4–16 | E. faecalis — 64E. faecium — 32 | S ≤ 4, R > 4 (тест на вы- сокие уровни устойчивости) | - | 1–2–4–8–16–32–64–128 |
| Тетрациклин | 0,5–2 (E. coli ATCC 25922) | 4 | - | S ≤ 4, I = 8, R ≥ 16 | 0,125–0,25–0,5–1–2–4–8–16–32 |
| Ванкомицин | 1–4 | 4 | S ≤ 4, R > 4 | S ≤ 4, I = 8–16, R ≥ 32 | 0,25–0,5–1–2–4–8–16–32–64 |
| Бацитрацин | - | 32 | - | - | 8–16–32–64 |
| Вирджиниамицин | - | E. faecalis — 32E. faecium — 4 | - | - | 1–2–4–8–16–32–64 |
| Campylobacter jejuni и Campylobacter coli (Контрольный штамм Сampylobacter jejuni 33560) | |||||
| Ципрофлоксацин | - | С. coli — 0,5С. jejuni — 0,25 | S ≤ 0,001, R > 0,5 | - | 0–0005-0,001–0,002–0,004–0,008–0,016–0,03–0,06– 0,125–0,25–0,5–1 |
| Эритромицин | - | С. coli — 8С. jejuni — 4 | C. coli: S ≤ 8, R > 8 С. jejuni: S ≤ 4, R > 4 | - | 1–2–4–8–16 |
| Гентамицин | - | 2 | - | - | 0,5–1–2–4 |
| Стрептомицин | - | 4 | - | - | 1–2–4–8 |
| Тетрациклин | - | С. coli — 2С. jejuni — 1 | S ≤ 2, R > 2 | - | 0,5–1–2–4 |
Концентрации в ячейках планшета, мг/л: 0–0005-0,001–0,002–0,004–0,008–0,016–0,03–0,06–0,125–0,25–0,5–1–2–4–8–16–32–64–128–256–512–1024.
7. Работа с AMRcloud
AMRcloud — это онлайн-платформа для обработки, систематизации и визуализации данных по антибиотикорезистентности. AMRcloud предполагает ввод первичных данных (значений МПК или диаметров зон подавления роста), обладает простым и удобным интерфейсом, по сравнению с ручным способом обработки данных обладает следующими особенностями и преимуществами:
- Широкие возможности по анализу данных благодаря наличию многочисленных фильтров и инструментов, выводящие их восприятие на принципиально другой уровень.
- Значительная экономия времени для выгрузки таблиц и построения графиков.
- Автоматическая интерпретация МПК по системам критериев EUCAST и СLSI значительно экономит время и устраняет возможность ошибок.
- Cтатистическая обработка с определением 95% доверительного интервала устраняет необходимость в применении дополнительных программ.
- Геокодирование позволяет создавать интерактивные карты.
- Создание ссылок позволяет делиться наборами данных.
Порядок работы с платформой AMRcloud описан в разделе 5 «Использование платформы AMRcloud в мониторинге антибиотикорезистентности» Практического руководство по мониторингу антибиотикорезистентности с использованием платформы AMRcloud [16] .
7.1 Сведения об изолятах и шаблон для загрузки данных в AMRcloud
Для загрузки данных в AMRcloud их необходимо сохранить в формате xlsx или csv (форматы файлов могут быть созданы в программе Excel).
Таблица содержит сведения о каждом изоляте и МПК (в мг/л) или диаметр зон подавления роста (в мм) для каждого изолята и антибиотика. При этом важно, чтобы названия антибиотиков были написаны на английском языке без ошибок.
Можно рекомендовать следующий шаблон для Excel-таблицы с МПК для 70 наиболее часто включаемых в программах мониторинга антибактериальных препаратов.
В шаблоне даны правильные названия антибиотиков, распознаваемые программой.
Названия некоторых полей указаны на английском языке, т.к. AMRcloud автоматически считывает эти названия при создании набора данных.
В таблице 11 представлены поля со сведениями об изолятах из шаблона Excel-таблицы. Заполнить информацию в этих полях целесообразно для более полноценного анализа полученных данных.
Таблица 11. Рекомендуемая структура таблицы для загрузки данных в AMRcloud
| Название столбца | Комментарий |
| Organism_Group | Группа микроорганизмов, например, «Enterococcus» или «Salmonella» |
| Organism_Species | Вид микроорганизма, например, Enterococcus faecalis. В случае, если точная информация о виде микроорганизма отсутствует, его в данном поле необходимо указывать как «Enterococcus spp.», для Salmonella entericа в случае отсутствия сведений о серотипе, следует указывать «Salmonella entericа». При этом необходимо учитывать, что при автоматической интерпретации данных по критериям микробиологической устойчивости EUCAST (EUCAST ECOFFs) в AMRcloud, количества антибиотиков, для которых интерпретация будет проведена, может значительно отличаться для вида/серотипа и рода/вида микроорганизма. Например, если указать изолят как «Salmonella Dublin, то будет определена устойчивость только к одному антибиотику, если тот же изолят Salmonella Dublin указать как «Salmonella entericа», то устойчивость будет определена уже для 47 антибиотиков, т.к. будут применены критерии общие для всех серотипов Salmonella entericа. Таким образом, для максимально полной интерпретации данных по сальмонеллам по критериям микробиологической устойчивости, целесообразно для всех изолятов в данном поле указывать «Salmonella enterica». Для энтерококков, стафилококков, стрептококков, необходимо указывать вид, для листерий критерии интерпретации EUCAST ECOFFs есть только для вида Listeria monocytogenes. Уточнить видо- и родо-специфические критерии микробиологической устойчивости можно на официальном сайте EUCAST [19] . |
| Unique_ID | Уникальный порядковый номер изолята, например «1532». |
| Isolate_ID | Порядковый номер изолята, для удобства в работе в нём могут быть зашифрованы какие-то сведения о нём, например «Efbroilertush2» — «Enterococcus faecalis, бройлеры, смыв с тушки, номер 2». Данное поле не является обязательным, для каждого изолята достаточно и уникального порядкого номера. |
| Date | Дата в следующих форматах «2018–12-31», «2018–31-12», «31–12-2018», «12–31-2018». |
| Группа_животных | Одна из следующих групп: птица, крупный рогатый скот, мелкий рогатый скот, свиньи, рыба и т.д. |
| Вид_животного | Например, домашний гусь (Anser anser). Для разных видов животных устойчивость у одних и тех же бактерий может значительно отличаться, например, у кишечной палочки от индейки устойчивость к разным антибиотикам, как правило, выше, чем от кур. |
| Категория | Например, для кур — цыплята бройлеры и куры несушки, для крупного и мелкого рогатого скота — мясной и молочный скот. Также могут быть категории молоди и взрослых животных, либо несколько категорий разного возраста, самцы и самки, порода животных и т.д. Все эти параметры также могут оказывать влияние на уровни устойчивости и, при наличии соответствующих данных, целесообразно учесть их при анализе. В данное поле также могут быть указаны сведения о том, применялись ли для животных антибиотики. Если информации много и нужна более тщательная её фильтрация, целесообразно создать дополнительное поле с информацией о животном, например, «Применение антибиотиков». |
| Тип_образца | Один из следующих типов: Биоматериал животных, объекты внешней среды, пищевое сырьё/продукция, входящий материал (корм, подстилка). |
| Образец | Конкретное указание типа материала, из которого был выделен изолят: фекалии, цекум, смыв, назальный смыв, смыв с тушки, смыв с убойной ленты, мясо, молоко и т.д. |
| Тип места отбора проб | Один из следующих типов: хозяйство, убойный пункт, объект розничной торговли и т.д. |
| Место отбора проб | При наличии такой информации и договорённости с предприятием о возможности могут быть указаны конкретные хозяйства, убойные пункты, объекты розничной торговли. Для крупных птицеводческих хозяйств можно указать конкретные цеха для того, чтобы отдельно анализировать данные по разным эпидемиологическим единицам. Например, ООО «Важная птица», цех №7. |
| Geo_Point | Местонахождение отбора проб. Возможно указание как в виде точных координат, так и в виде ближайшего населённого пункта, области или региона. Например, «Шебекино, Белгородская область», «Ракитянский район, Белгородская область» или «Алтайский край». |
| Метод | Данное поле необходимо, если были использованы различные протоколы выделения/определения чувствительности бактерий к антибиотикам. Например «Протокол EUCAST» или «Планшеты Sensititre» |
Также в зависимости от задач исследований и наличия данных могут быть добавлены дополнительные поля со сведениями об изолятах. При загрузке данных AMRcloud позволяет выбрать для фильтрации 10 полей.
7.2 Анализ и представление данных
AMRcloud предоставляет широкие возможности для анализа и представления данных по антибиотикорезистентности. Основные варианты, наиболее часто встречающиеся в отчётах и научных публикациях по исследованиям устойчивости зоонозных и индикаторных бактерий от животных представлены ниже.
Информация приведена для метода серийных разведений, но те же самые возможности AMRcloud предоставляет и при использовании диско-диффузионного метода.
7.2.1. Структура данных
Сведения о структуре данных, позволяющие сразу получить представление об объектах исследования, доступны во вкладке «Структура данных» в виде круговых диаграмм и карт.
Ниже для примера приведена диаграмма по группам бактерий (все данные на этом и других рисунках взяты из открытого проекта ФГБУ «ВГНКИ» на платформе AMRcloud [7] ).
7.2.2. Устойчивость ко всему спектру исследованных антибиотиков
При определении спектра устойчивости ко всем исследованным антибиотикам необходимо иметь в виду, что у разных видов микроорганизмов одного рода и у микроорганизмов одного и того же вида, выделенных от разных животных, профили устойчивости могут значительно отличаться.
Поэтому построение графика устойчивости микроорганизмов ко всем исследованным антибиотикам следует производить отдельно для каждого вида микроорганизмов и вида животных, от которых они были выделены, как на рисунке 2.
Для отображения на экране спектра устойчивости ко всем исследованным антибиотикам необходимо выбрать в AMRcloud вкладку «Антибиотики (все)».
Для вывода с теми же данными в форме таблицы, следует воспользоваться вкладкой «Таблица» во вкладке «Антибиотики (все)».
В зависимости от задач исследования и для оценки влияния типа образца и образца целесообразно также на примере одной или нескольких комбинацией «вид микроорганизма — вид животного» построить графики отдельно для разных категорий «тип образца» и образец. Например, из типа образца «пищевая продукция» могут быть выделены микроорганизмы с уровнями устойчивости, отличающимися от типа «биоматериал животных», поскольку пищевая продукция с большой вероятностью может быть загрязнена изолятами от людей.
По той же самой причине могут быть отличия в уровнях устойчивости изолятов из разных категорий «образец». Так, при выделении бактерий из цекума минимальна вероятность контаминации бактериями от людей, а из смывов с конвеерной ленты она значительна.
7.2.3. Устойчивость к выбранному антибиотику
Для приоритетных антибиотиков целесообразно провести более детальный анализ. Например, для E. coli это колистин — резервный для медицины препарат, устойчивость к которому главным образом обусловлена активным использованием для животных в профилактических целях.
График распределения МПК (для метода серийных разведений)
Выше дано описание того, что сравнение графика распределения МПК с табличным является дополнительным инструментов контроля качества данных. В отчётах и научных публикациях также помещают графики распределения МПК.
Для построения графика распределения МПК следует выбрать вкладку «Выбранный антибиотик», далее «МПК». В данном случае могут быть взяты все образцы какого-то конкретного вида бактерии, независимо от вида животных и других параметров (рисунок 3).

Для сравнения, ниже (рисунок 4) приведён табличный график распределения МПК с сайта EUCAST [19] , для построения которого были использованы данные по 6014 изолятам (см. раздел 7.1. «Выбор разведений при постановке метода серийных разведений с определением МПК и контроль качества»).
При сопоставлении графиков, с одной стороны, заметно то, что в нашем исследовании диапазон МПК оказывается значительно уже, чем у EUCAST, и пики на двух графиках различны. C другой стороны наш диапазон не выходит за пределы диапазона EUCAST, т.е. смещения распределения относительно табличного не наблюдается. Таким образом, может быть сделан вывод о валидности экспериментальных данных.
График зависимости устойчивости от вида, категорий животных, типа образца, года исследований, конкретных хозяйств и т.д.
С целью более детального анализа ситуации с приоритетными антибиотиками целесообразно установить, от каких факторов она зависит. Для этого необходимо во вкладке «Выбранный антибиотик» открыть подвкладку «S/I/R графики», затем подвкладку «Группировать по» (рисунок 5).
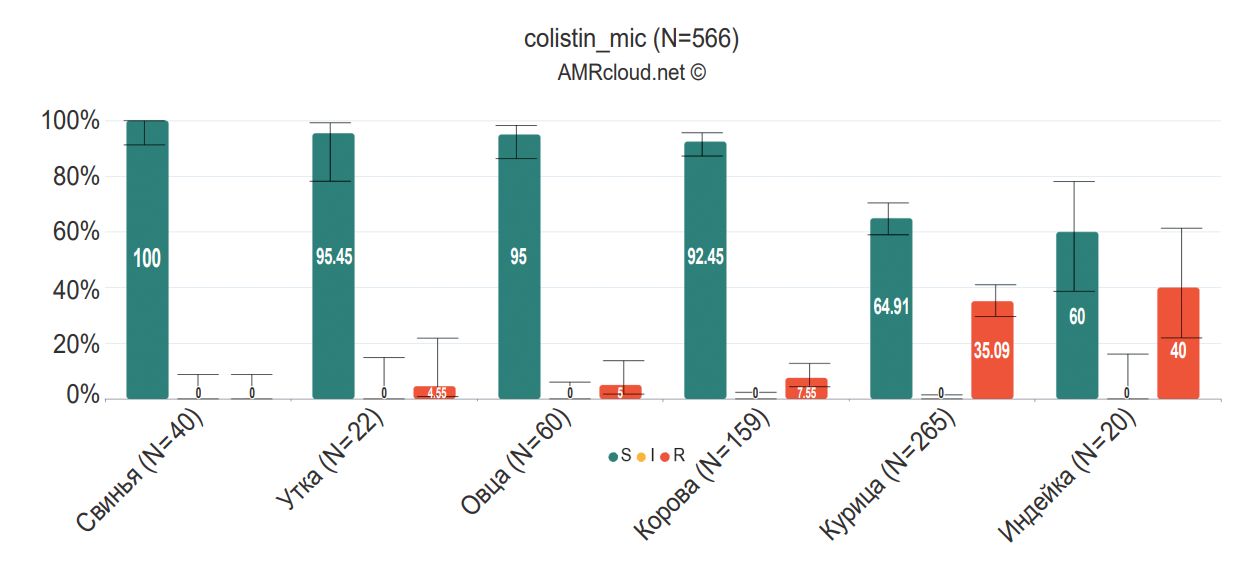
Из графика видно, насколько сильно устойчивость отличается у бактерий, полученных от разных животных.
Карта устойчивости
Построение карты устойчивости к конкретному антибиотику доступно во вкладке «Выбранный антибиотик», далее подвладка «Карта» (рисунок 6). Красным цветом на рисунке бозначена доля устойчивых изолятов, зелёным — доля чувствительных, число — количество устойчивых или чувствительных изолятов.
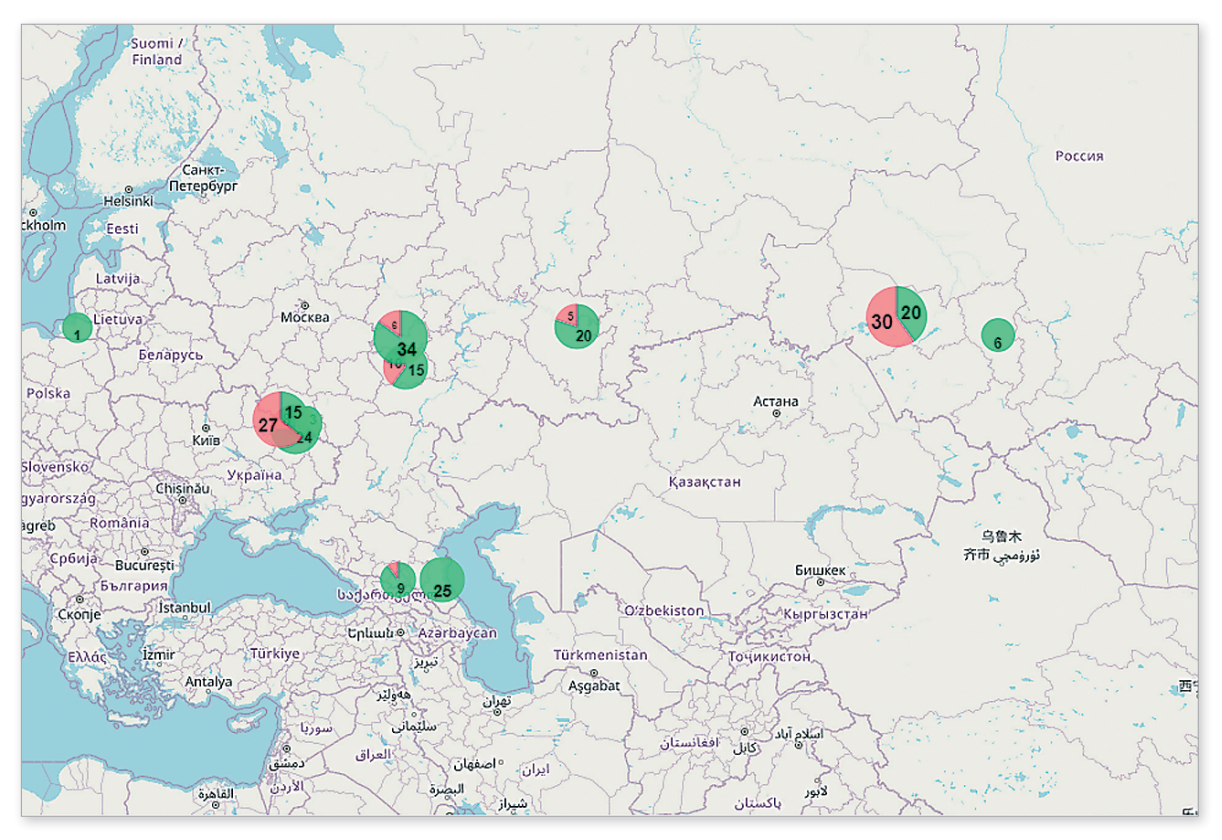
Ассоциированная и множественная устойчивость
При открытии во вкладке «Ассоциированная устойчивость» подвкладки «Матрица», на экран выводится таблица, в которой для каждой пары антибиотиков можно узнать, какая доля изолятов (в %), устойчивых к первому антибиотику, будет устойчива и ко второму.
Множественная устойчивость изолятов, т.е. одновременная устойчивость к разным классам антибиотиков, является важным показателем общих уровней устойчивости, и соответствующие данные почти всегда включают в отчёты и публикации.
Согласно международным подходам, в частности, используемым в отчётах ECDC/EFSA (cм. 4. Раздел «Системы мониторинга и источники данных об антибиотикорезистентности зоонозных и индикаторных бактерий, выделяемых от животных»), изолят считается обладающим множественной устойчивость, или мультирезистентным, если он устойчив как минимум к трём антибиотикам из разных классов.
Для получения данных о множественной устойчивости, во вкладке «Ассоциированная устойчивость» необходимо использовать подвкладку «Множественная устойчивость», в поле «Антибиотик» следует выбрать по одному представителю из каждого класса антибиотиков, а в поле «R как минимум к N антибиотикам» выбрать значение 3.
AMRcloud позволяет определить одновременную устойчивость к любому количеству антибиотиков. На основании этих данных могут быть построены графики спектра множественной устойчивости, которые часто помещают в отчёты и статьи, посвящённые исследованиям антибиотикорезистентности бактерий, выделяемых от животных.
На графике (рисунок 10) по оси абсцисс обозначена доля изолятов, обладающей одновременной устойчивостью к 1–5 классам антибиотиков, а по оси ординат — разные комбинации бактерий и животных (E. faecalis и E. faecium от овец, свиней, индеек, коров и кур).
- E. faecium — овцы (N = 31)
- E. faecalis — свиньи (N = 49)
- E. faecium — индейка (N = 34)
- E. faecalis — утки (N = 31)
- E. faecium — коровы (N = 104)
- E. faecalis — коровы (N = 51)
- E. faecium — цыплята (N = 41)
- E. faecalis — цыплята (N = 146)
- sus (S + I) — доля изолятов, относящихся к категории чуствительных или чувствительным при повышенной экспозиции ко всем исследованным антибиотикам.
- res 1, 2, 3… — доля изолятов, одновременно устойчивых к 1, 2, 3… антибиотикам из разных классов.
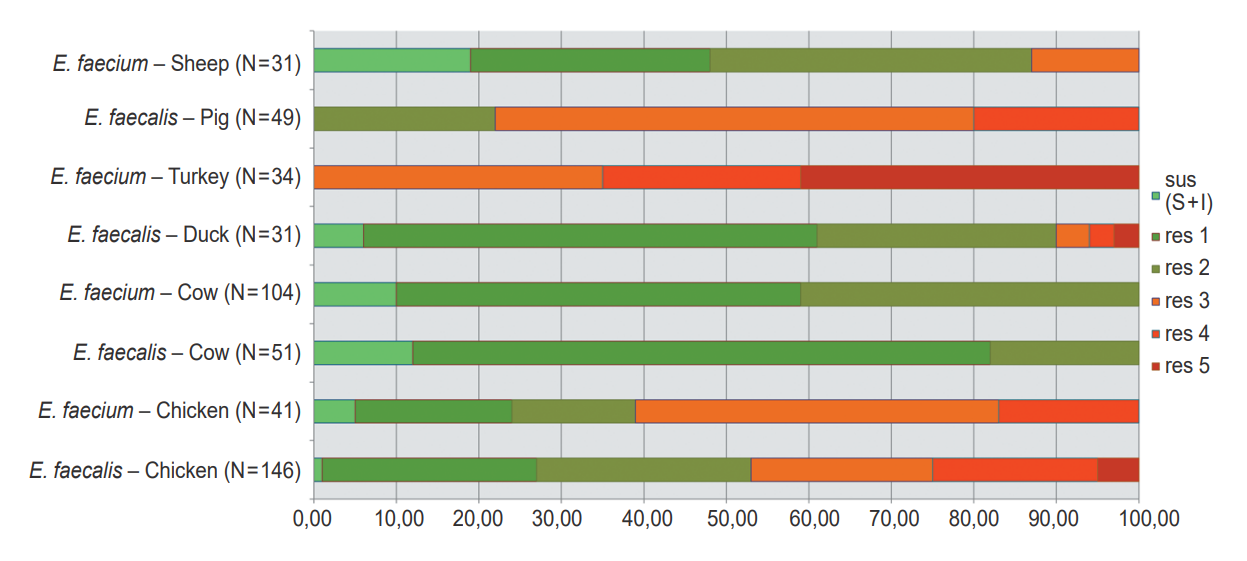
Резюмируя изложенное выше, можно предложить минимальный набор вкладок AMRcloud (таблица 12), которые необходимо использовать для полноценного анализа данных по мониторингу устойчивости зоонозных бактерий, выделяемых от животных и из продуктов питания (на примере данных с МПК).
Таблица 12. Минимальный набор вкладок для анализа данных в AMRcloud (на примере данных с МПК)
| Вкладки | Подвкладки |
| Структура данных | «Структура данных по» группам и видам микроорганизмов«Структура данных по» группам и видам животных«Структура данных по» типу образца и образцу«Структура данных по» месту отбора проб |
| Антибиотики все | «График» отдельно для каждого вида микроорганизма и каждого вида животного (каждой комбинации микроорганизм/вид животного), также на примере какой-то одной комбинации построить графики для разных типов и видов образцов. |
| Выбранный антибиотик | «График» для наиболее важных антибиотиков (также отдельно для каждой комбинации микроорганизм/вид животного)«Группировать по» виду животного, по месту отбора проб, по типу образца«Карта»«МПК», сравнение с табличными значениями EUCAST |
| Ассоциированная устойчивость | «Матрица»«Множественная устойчивость», оценка одновременной устойчивости к трём антибиотикам из разных классов |
8. Пример решения практической задачи, связанной с мониторингом устойчивости зоонозных бактерий, выделенных от животных
Для более полного ознакомления с возможностями AMRcloud в решении задач, которые можно поставить перед ветеринарным мониторингом, предлагаем решение практической задачи.
8.1 Данные и цели
Данные: устойчивость E. coli, выделенных от кур и коров к 10 антибактериальным средствам: ампициллину, цефотаксиму, хлорамфениколу, ципрофлоксацину, колистину, гентамицину, меропенему, моксифлоксацину, триметоприму и комбинации триметоприм-сульфаметоксазол (МПК).
Данные представляют собой реальный результат мониторинговых исследований ФГБУ «ВГНКИ». Более подробно с проводимым учреждением мониторингом можно ознакомиться на странице открытого проекта ФГБУ «ВГНКИ» в AMRcloud [7] .
Файл с данными для практической задачи доступен по ссылке: https://vet.amrcloud.net/files/example.xlsx
Наборы данных для практической задачи в AMRcloud доступны по ссылкам ниже.
- Набор №1 (интерпретация по EUCAST 2022) https://public.amrcloud.net/link?id=acTCA175v555v08
- Набор №2 (интерпретация по EUCAST ECOFFs) https://public.amrcloud.net/link?id=9f9UV59vK55vK08
Данные интерпретировалипо критериям клинической устойчивости EUCAST 2022 года (версия 12) [20] и критериям микробиологической устойчивости EUCAST ECOFFs [19] .
Цели:
- Провести анализ данных.
- Оценить валидность данных.
- Оценить наличие проблемы с устойчивостью кишечной палочки от животных.
- Выбрать приоритетный для внедрения мер по противодействию устойчивости вид животных.
- При необходимости, внести коррективы в планирование дальнейшего мониторинга.
8.2 Решение задачи
8.2.1. Обзор структуры данных
В первую очередь необходимо познакомиться с данными и изучить их структуру. Откроем вкладку «Структура данных», в окне «Структура данных по» в нижней части экрана слева по очереди выберем «Вид_животного», «Образец» и «Geo_point», каждый раз нажимая кнопку «Отобразить» для отображения диаграмм.
Все изоляты относятся к виду E.coli. Структура по видам животных показывает, что данные содержат МПК 237 изолятов от кур и 145 от коров, всего 382 изолята (рисунок 1).
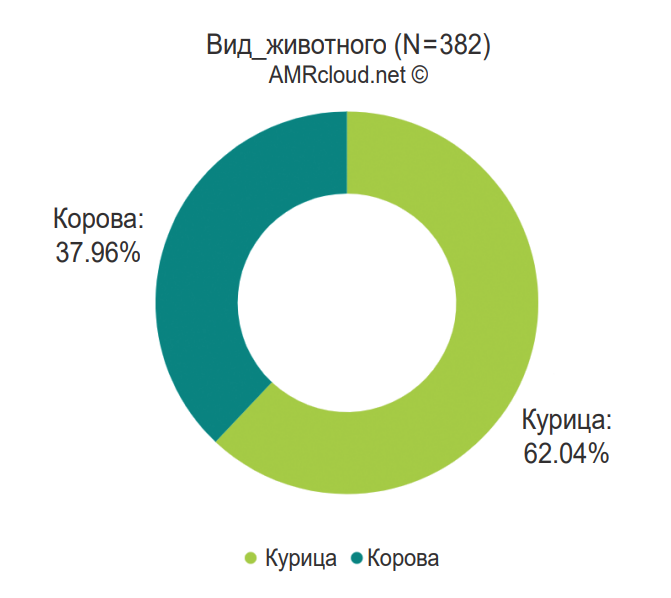
Все изоляты от коров были выделены из фекалий, изоляты от кур были выделены из фекалий — 84 изолята и из смывов с тушки — 153 изолята (рисунок 2).
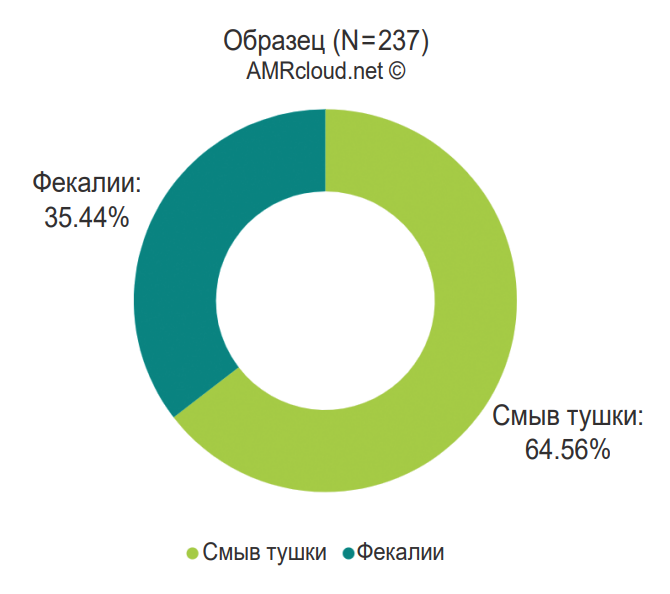
Можно выполнить оценку структуры данных в зависимости от места отбора проб.
Из рисунка 3 видно, что географический охват исследований составил 16 регионов России, от Южного Кавказа до Приморского края. Наибольшее количество изолятов было отобрано из Белгородской, Новосибирской, Калужской, Воронежской областей, Дагестана, Пензенской, Челябинской, Тверской областей, Республики Северная Осетия — Алания.
Таким образом, среди регионов с наибольшим количеством изолятов представлены разные части страны — Центральная Россия, Сибирь, Кавказ, Поволжье.
Это позволяет сделать вывод, что данные репрезентативны для страны и позволяют распространить выводы на отечественное сельское хозяйство в целом.
8.2.2. Спектр устойчивости к антибиотикам
Влияние вида образца
Все изоляты от коров были выделены из фекалий, а от кур — из фекалий и смывов с тушки.
Для того, чтобы корректно сравнивать данные от коров и кур, необходимо учитывать влияние фактора образца. Если спектры устойчивости изолятов от кур, выделенных из фекалий и смывов с тушки значительно различаются, для сравнения с изолятами от коров необходимо брать куриные изоляты только из фекалий. Если отличия между спектрами устойчивости куриных изолятов из фекалий и из смывов с тушек несущественное, для сравнения спектров устойчивости от кур и коров можно брать все изоляты от кур.
Посмотрим на спектры устойчивости изолятов от кур, выделенных их фекалий и из смывов с тушки. Для этого откроем вкладку «Антибиотики все», в поле «Вид_животного» выберем «Курица», а в поле «Образец» выберем сначала «Смыв с тушки», и, нажав кнопку «Отобразить», выведем на экран соответствующую диаграмму, а затем выберем «Фекалии».
Зелёный столбец на графиках — это доля изолятов из категории «Чувствительный», жёлтый столбец — доля изолятов из категории «Чувствительный при увеличенной экспозиции (ранее эта категория называлась «Промежуточно устойчивый», красный — из категории «Устойчивый». Значение «N» под столбцами показывает количество изолятов, исследованных на каждый антибиотик. Чёрточки вверху столба показывают диапазон значений в 95%-доверительном интервале.
Как видно из рисунка, значительное отличие заметно только для одного антибиотика — ампициллина, устойчивость к которому значительно выше у изолятов из фекалий.
Таким образом, для сравнения спектров устойчивости изолятов от коров и кур, для последних можно использовать объединённые данные по двумвидам образцов — смывам с тушки и фекалиям.
Сравнение спектров устойчивости от коров и от кур
Посмотрим спектр устойчивости отдельно для кур и для коров. Для этого необходимо открыть вкладку «Антибиотики (все)», в поле «Вид_животного» (вверху экрана на панели «Параметры основные») выберем сначала «Корова», а потом выберем «Курица», выводя графики на экран.
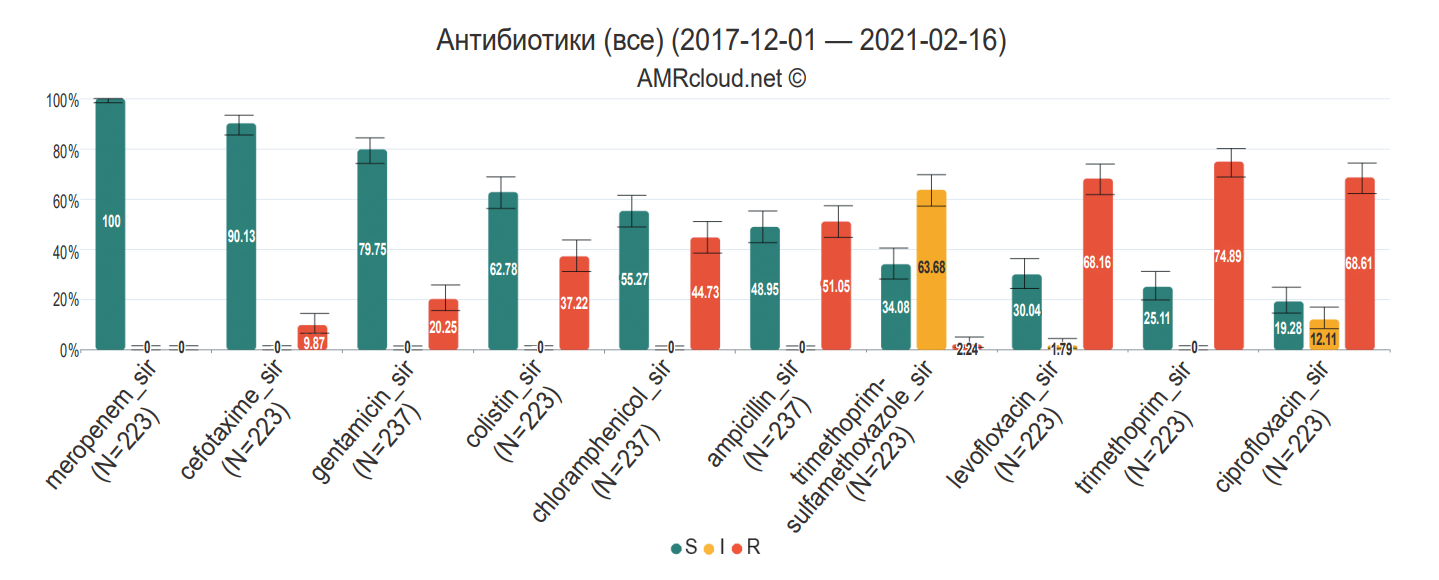
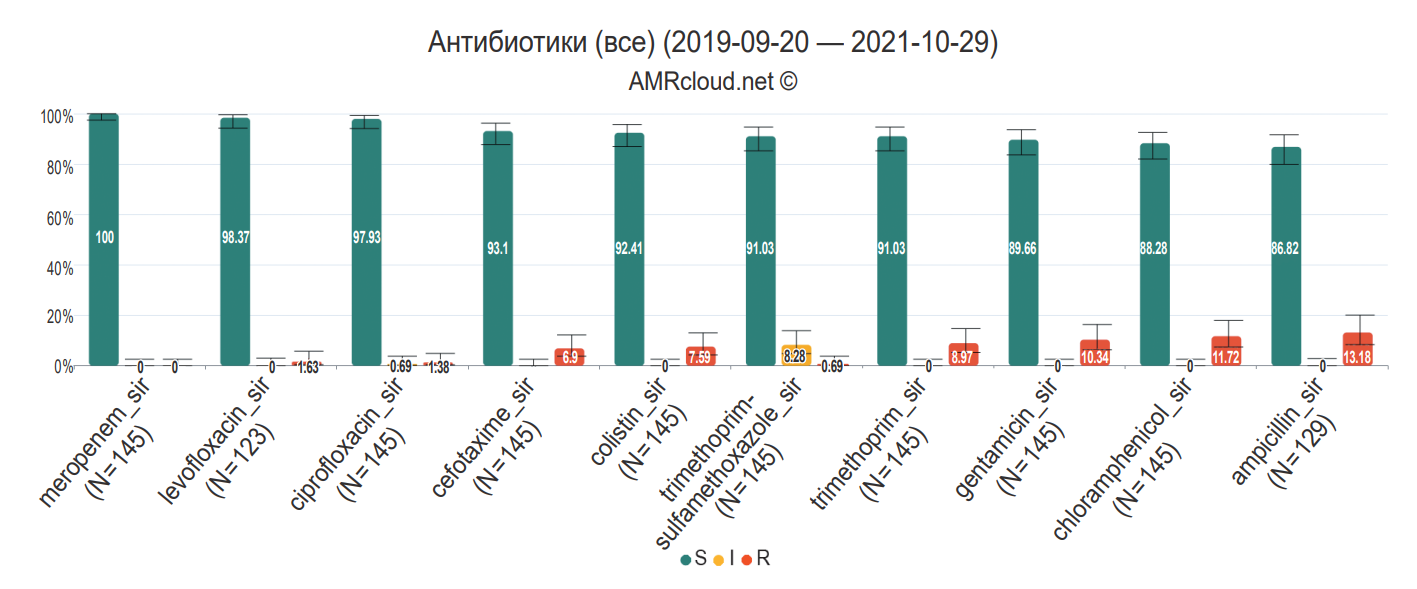
Из рисунков видно, что спектр устойчивости бактерий от кур и коров имеет значительные отличия. Практически ко всем исследованным антибиотикам устойчивость изолятов от кур значительно выше, чем от коров.
У изолятов от коров устойчивость к ампициллину, хлорамфениколу, гентамицину, триметоприму, комбинации триметоприм-сульфаметоксазол, колистину, цефотаксиму, ципрофлоксацину и левофлоксацину составила составила менее 15%. В то же время у выделенных от кур изолятов устойчивость к ципрофлоксацину, левофлоксацину, триметоприму и ампициллину была более 50%, к гентамицину, колистину и хлорамфениколу — от 20 до 50%, к цефотаксиму — порядка 10%, в отношении комбинации триметоприм/сульфаметоксазол 64% изолятов были отнесены к категории «чувствительные при увеличенной экспозиции». Таким образом, ситуацию с антибиотикорезистентностью в птицеводстве хуже, чем при выращивании КРС. Куры могут рассматриваться как приоритетный, по сравнению с коровами, вид животных для принятия управленческих мер, основа которых — минимизации использования антибиотиков.
8.2.3. Выбранные антибиотики
Целесообразно отдельно рассмотреть устойчивость к наиболее важным из исследованных антибиотиков, например, колистин (группа полимиксинов), цефотаксим (цефалоспорин III поколения) и фторхинолоны (ципрофлоксацин и левофлоксацин), все эти антимикробные средства указаны в рекомендациях международных организаций — ВОЗ, МЭБ и ФАО как антибиотики, применение которых в животноводстве представляет наибольший риск распространения антибиотикорезистентности среди зоонозных бактерий и угрозу здравоохранению [14] [15] [17] . Также к группе наиболее важных антибиотиков относится меропенем из класса карбапенемов. ВОЗ включила устойчивые к карбапенемам и продуцирующие БЛРС E.coli в группу критического приоритета для разработки новых антибиотиков [13] .
Устойчивых к меропенему изолятов не было выделено ни от кур, ни от коров, что говорит о том, что данный антибиотик, не зарегистрированный в России для продуктивных животных [18] , либо не применяется совсем, либо применяется редко.
Для цефотаксима, колистина, ципрофлоксацина и левофлоксацина для удобства построим графики зависимости устойчивости от вида животного и сравним данные с данными из Евросоюза. Поскольку в базе данных Евросоюза были использованы критерии микробиологической устойчивости EUCAST ECOFFs (Epidemiological Cut-off Values), точки отсечения эпидемиологической (микробиологической) устойчивости, используем интерпретацию данных по EUCAST ECOFFs.
В целом значения микробиологической устойчивости также важны для оценки распространения антибиотикорезистентности, и их следует использовать в мониторинге наряду со значениями клинической устойчивости.
Для построения диаграмм откроем вкладку «Выбранные антибиотики», затем в поле «Антибиотик» выберем «cefotaxime_sir» (либо сefotaxime_mic, если переключатель в поле «Источник данных S/I/R») стоит в позиции «Автоинтерпретация из МПК»). Откроем подвкладку «Группировать по» и в качестве группирующего признака выберем «Вид_животного», затем нажмем на кнопку «Отобразить». Повторим данные действия для ципрофлоксацина, левофлоксацина и колистина.
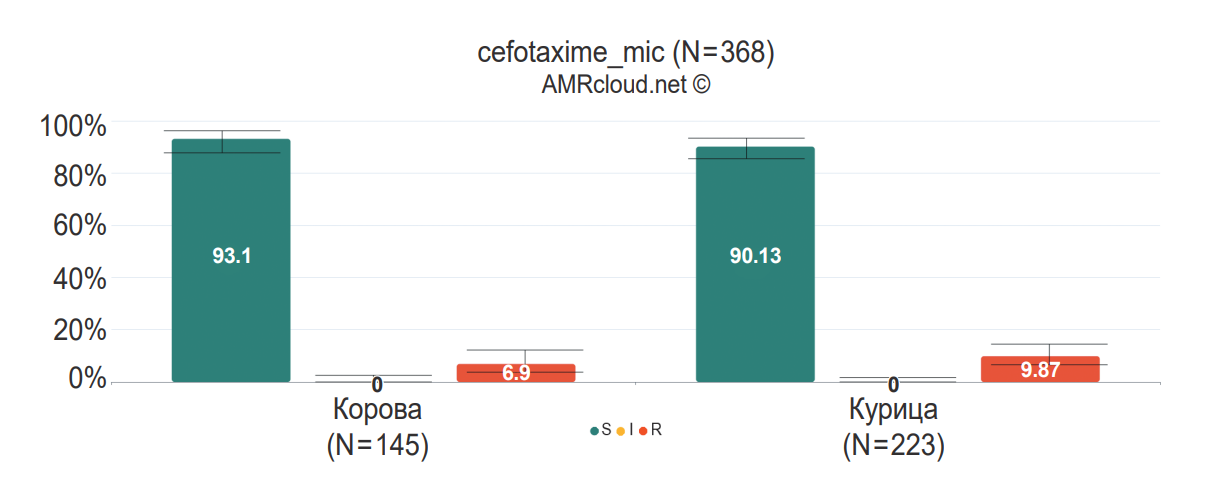
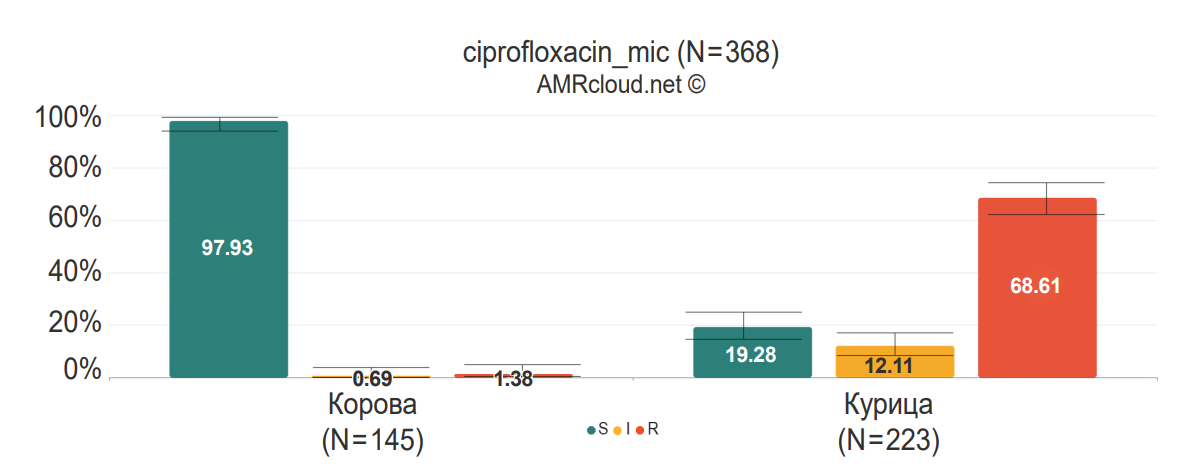
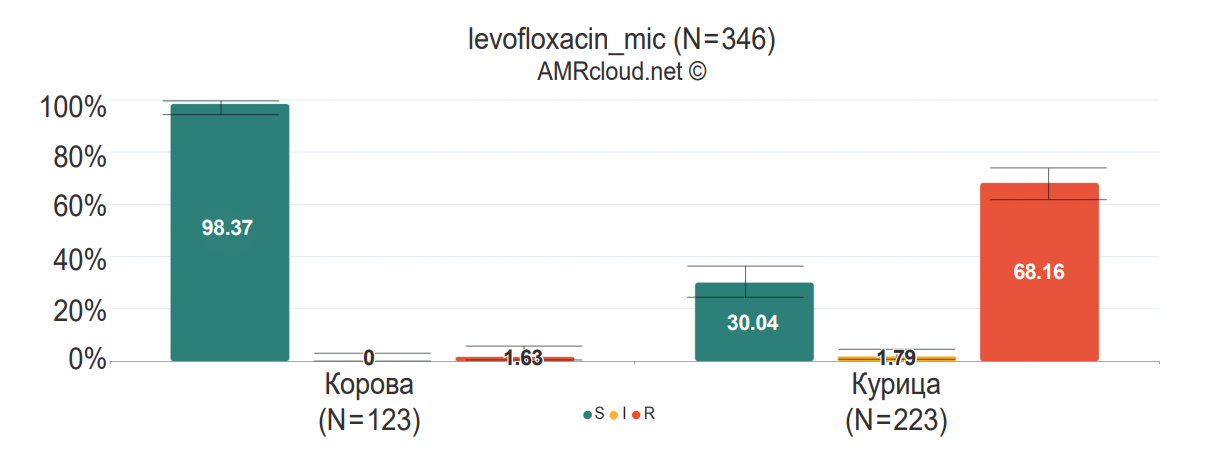
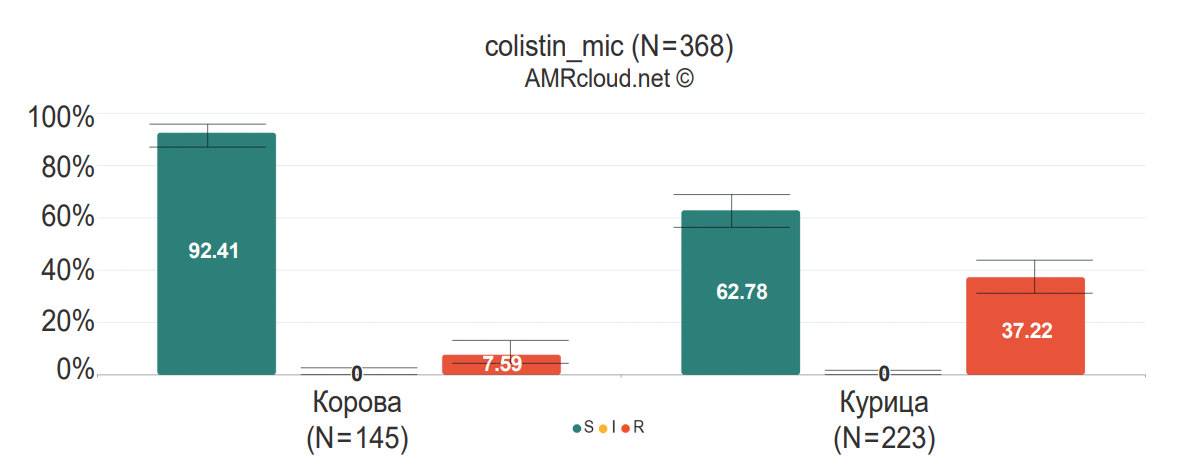
К цефотаксиму устойчивыми отказались 8% изолятов от коров и 10% изолятов от кур. Это относительно высокие значения. Так, в среднем по Евросоюзу согласно данным за 2020 год [3] , только 1,5% изолятов от бройлеров были устойчивы к цефотаксиму (при этом для отдельных стран были также зафиксированы высокие значения с максимумом для Мальты — 33%).
Устойчивыми к ципрофлоксацину и левофлоксацину оказались 88% изолятов от кур и 9% изолятов от коров. В Евросоюзе при этом средняя устойчивость была зафиксирована на уровне 55%, однако в отдельных странах достигала и намного больших значений, в частности 92% в Латвии и 96% в Словакии [3] .
К колистину устойчивыми оказались 7,6% изолятов от коров и 37% изолятов от кур. Последнее значение может быть сочтено чрезвычайно высоким. Так, по данным из Евросоюза за 2020 г., в среднем 1,2% изолятов E.coli от бройлеров [3] оказались устойчивыми к колистину, среди, которых данный показатель оказался значительно выше среднего — Болгария (6%), Кипр (10%), Германия (9%) и Румыния (4%).
Необходимо отметить, что такой высокий уровень устойчивости к наиболее важным антибиотикам характерен не только для нашей страны. Например, в Китае были зафиксированы уровни устойчивости к колистину кишечной палочки от бройлеров на уровне 35% [5] .
8.2.4. Диаграмма распределения МПК
С целью проверки валидности наших данных сравним распределение МПК с табличным на примере цефотаксима.
Для этого во вкладке «Выбранный антибиотик» откроем подкладку «МПК» и выведем на экран график распределения МПК для цефотаксима.
Чтобы увидеть табличное распределение EUCAST, необходимо воспользоваться разделом официального сайта [19] «EUCAST MIC distributions and ECOFFs» («Распределение МПК и микробиологические точки отсечения»), далее кнопка «Search database» («Поиск по базе данных»), выбираем из списка в поле «Antimicrobial» («Антимикробное средство») антибиотиков cefotaxime и в открывшемся списке бактерий выбрать «Escherichia coli», после чего на экран будет выведен график распределения.
Сравнение полученного графика с табличными показывает, что диапазон зафиксированных нами концентраций не выходит за рамки диапазона EUCAST, значения пиков также совпадают, из чего делаем вывод о валидности наших данных. Схожая картина была получена и для других антибиотиков.
Если полученный график оказался бы смещён в правую или левую сторону относительно табличного распределения, это бы не означало автоматически, что данные не валидны, но послужило бы указанием к более тщательному контролю качества другими способами, в частности, с использованием контрольных штаммов.
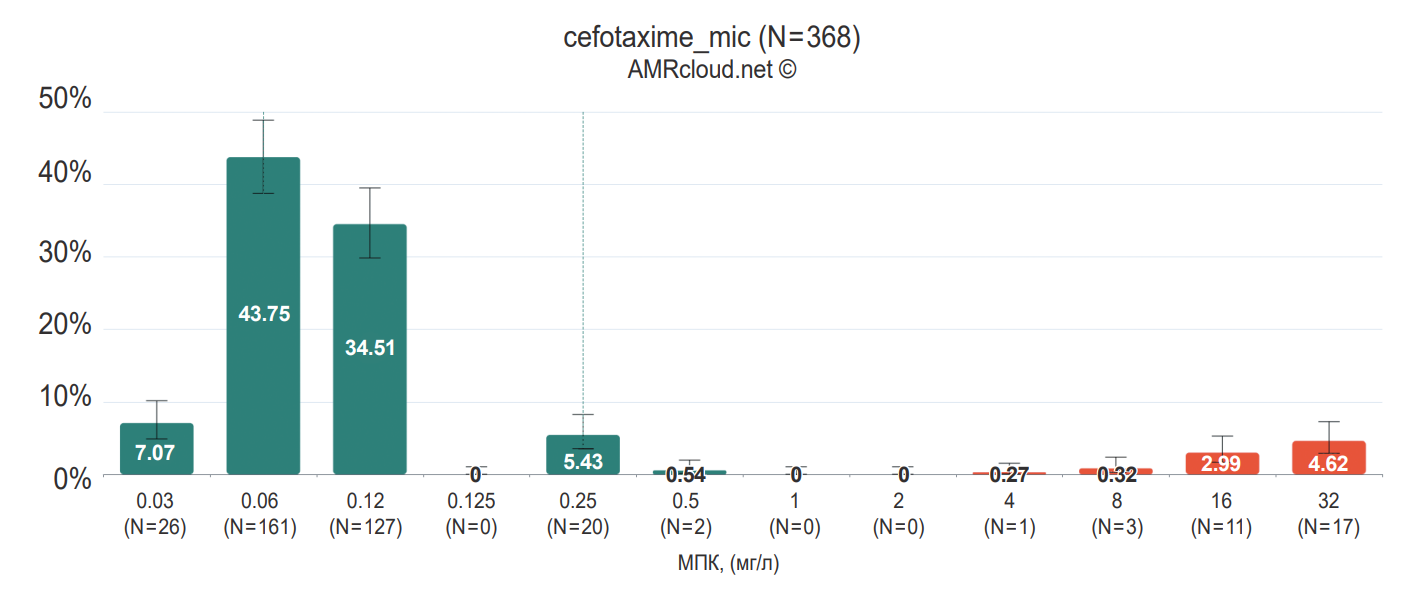
По оси Х на графике отложены значения МПК в мг/л, по оси У — доля изолятов, для которых было зафиксировано данное МПК. Как и на предыдущих диаграммах, зелёные столбцы обозначают изоляты в категории «Чувствительный», красные — в категории «Устойчивый».
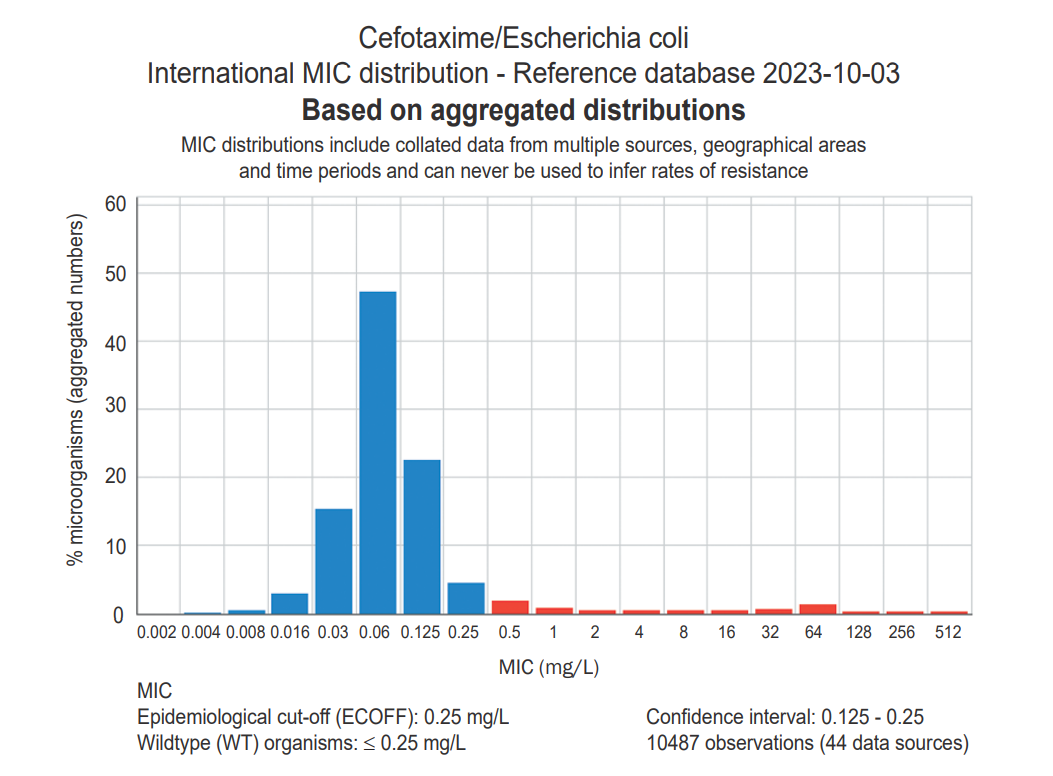
На графике по оси Х — МПК в мг/л, по оси У — доля изолятов с указанным МПК (от общего количества исследованных).
8.2.5. Карта устойчивости
Чтобы выяснить, носит ли устойчивость локальный характер или характерна для масштабов всей страны, посмотрим карту устойчивости на примере ципрофлоксацина у изолятов от кур. Для этого во вкладке «Выбранный антибиотик» выберем подкладку «Карта» и выведем карту на экран.
Зелёный и красный цвет на кругах обозначают долю чувствительных и устойчивых изолятов, число — количество изолятов той или иной категории.
Из карты видно несмотря на то, что наибольшая доля устойчивых изолятов зафиксирована в Поволжье, в целом устойчивость достаточна распространена в разных частях страны.
Аналогичная картина глобальной устойчивости была получена и для других антибиотиков. Таким образом, устойчивость не фиксируется в каких-то отдельных регионов, но, скорее, распространена в масштабах всей страны.
8.2.6. Ассоциированная устойчивость
Матрица ассоциированной устойчивости
Построим матрицу ассоциированной устойчивости, чтобы определить вероятность наличия одновременной резистентности изолята к двум разным АМП.
Для этого во вкладке «Ассоциированная устойчивость» выберем подвкладку «Матрица».
Близкая к 100% ассоциированная устойчивость зафиксирована к двум антибиотикам из класса фторхинолонов — ципрофлоксацину и левофлоксацину. Наведя курсор на значение «100», в перекрестье между ципрофлоксацином и левофлоксацином увидим надпись «Если R к levofloxacin_mic → R к ciprofloxacin_mic = 100%», что означает, если N изолятов устойчивы к левофлоксацину, из них 100% будут устойчивыми и к ципрофлоксацину.
Наведя курсор на значение «99,35%» во втором перекрестье между ципрофлоксацином и левофлоксацином, увидим надпись «Если R к ciprofloxacin_mic → R к levofloxacin_mic = 99,35%», что означает, если N изолятов устойчивы к ципрофлоксацину, из них 99,35% будут устойчивыми и к ципрофлоксацину.
Также высокие уровни устойчивости видны и для других комбинаций антибиотиков, например, 91% изолятов, устойчивых к левофлоксацину, устойчивы также и к триметоприму.
Таким образом, ципрофлоксацин и левофлоксацин обладают практически 100%-ной перекрёстной устойчивостью. Для целей мониторинга целесообразно не расходовать ресурсы на анализ устойчивости к обоим антибиотикам, но для дальнейших исследований выбрать какой-то один из них. Ципрофлоксацин значительно более активно, чем левофлоксацин применяется в ветеринарии, а также более активно в медицине, и именно его из всех фторхинолонов в первую очередь включают в программы мониторинга устойчивости зоонозных бактерий. Следовательно, из двух фторхинолов в программе мониторинга целесообразно оставить ципрофлоксацин.
Множественная резистентность
Множественная резистентность является важным показателем устойчивости бактерий, соответствующие сведения предствавляют как в отчётах [2] , так и в научных публикациях [26] [27] . Как правило, это одновременная устойчивость как минимум к трём антимикробным средствам из разных классов.
Для определения мультирезистентности изолятов от кур во вкладке «Ассоциированная устойчивость» откроем подвкладку «Множественная устойчивость». В поле «Антибиотик» необходимо поставить галочки напротив представителя каждого класса антибиотиков. В представленном случае все антибиотики из разных классов, кроме ципрофлоксацина и левофлоксацина, из которых выберем первый.
В поле «R как минимум к N антибиотикам» выберем значение «3» и увидим, что 147 из 223 изолятов — 65,92% (59,48–71,82 в 95% доверительном интервале) обладают свойством мультирезистентности.
8.3 Выводы
По результатам анализа полученных данных могут быть сделаны следующие выводы согласно поставленным целям:
- Сравнение спектра устойчивости изолятов E. coli, выделенных из фекалий кур и смывов с тушки, показало их высокую схожесть, таким образом, для дальнейших исследований можно брать любой из данных видов образцов.
- Сравнение графиков распределения МПК, полученных в исследовании, с референтными значениями EUCAST показало, что данные валидны.
- С учётом полученных данных о практически 100%-ной перекрёстной устойчивости левофлоксацина и ципрофлоксацина и более широкому применению последнего в ветеринарии и общественном здравоохранении, для целей дальнейшего мониторинга рекомендуется использовать именно ципрофлоксацин.
- Высокие уровни устойчивости изолятов E. coli от кур к антибактериальным средствам, в том числе к наиболее важным — цефалоспоринам III и выше поколений (цефотаксим), фторхинолонам (ципрофлоксацин и левофлоксацин) и колистину. Это может быть связано с активным применением данных антибиотиков в птицеводстве с профилактическими целями.
- Устойчивость не характерна для каких-то отдельных регионов, но может быть рассмотрена в масштабе всей страны.
- Куры, по сравнению с коровами, приоритетны для внедрения мер по противодействию устойчивости, основой которых является минимизация применения антибиотиков.
Литература
1. World Health Organization (WHO), Food and Agriculture Organization of the United Nations (FAO) and World Organisation for Animal Health (OIE). Taking a Multisectoral, One Health Approach: A Tripartite Guide to Addressing Zoonotic Diseases in Countries , 2019
https://www.woah.org/app/uploads/2021/03/en-tripartitezoonosesguide-webversion.pdf
2. ECDC. The European Union Summary Reports on Antimicrobial Resistance in zoonotic and indicator bacteria from humans, animals and food in 2020/2021
3. ECDC/EFSA database «Antimicrobial resistance in Europe»
https://multimedia.efsa.europa.eu/dataviz-2020/index.htm
4. FDA. NARMS Now: Integrated Data
5. Zhang P, Shen Z, Zhang C, Song L, Wang B, Shang J, Yue X, Qu Z, Li X, Wu L, Zheng Y, Aditya A, Wang Y, Xu S, Wu C. Surveillance of antimicrobial resistance among Escherichia coli from chicken and swine, China, 2008–2015. Vet Microbiol. 2017;203:49–55
https://www.sciencedirect.com/science/article/pii/S037811351630801X?via%3Dihub
6. Cao T, Liu P, Li Y, Cui M, Zhang C, Wang Y, Shen Z, Shen J, Ke Y, Wang S, Wu Y. Prevalence of Salmonella and Antimicrobial Resistance in Isolates from Food Animals — Six PLADs, China, 2019
https://weekly.chinacdc.cn/fileCCDCW/journal/article/ccdcw/2021/24/PDF/210055.pdf
7. ФГБУ «ВГНКИ». Научно-исследовательская работа «Ветеринарный мониторинг и анализ риска антибиотикорезистентности зоонозных бактерий»
https://amrcloud.net/ru/project/vgnki
8. Журнал «Ветеринария сегодня»
https://veterinary.arriah.ru/jour
9. Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека. Государственный доклад. О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2021 году
https://www.rospotrebnadzor.ru/documents/details.php?ELEMENT_ID=21796
10. World Organisation for Animal Health. Terrestrial animal health code
11. Integrated Surveillance of Antimicrobial Resistance in Foodborne Bacteria: Application of a One Health Approach. Geneva: World Health Organization; 2017
https://apps.who.int/iris/handle/10665/255747
12. FAO. 2019. Monitoring and surveillance of antimicrobial resistance in bacteria from healthy food animals intended for consumption. Regional Antimicrobial Resistance Monitoring and Surveillance Guidelines — Volume 1. Bangkok
https://www.fao.org/publications/card/fr/c/CA6897EN
13. Tacconelli E, Carrara E, Savoldi A, Harbarth S, Mendelson M, Mannet DL, Pulcini C, Kahlmeter G, Kluytmans J, Carmeli Y, Ouellette M, Outterson K, Patel J et al. Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis. Lancet Infect Dis. 2017
https://www.sciencedirect.com/science/article/pii/S1473309917307533
14. WHO. Critically important antimicrobials for human medicine, 6th revision. Geneva: World Health Organization; 2019
https://www.who.int/publications/i/item/9789241515528
15. European Medicines Agency. Answer to the request from the European Commission for updating the scientific advice on the impact on public health and animal health of the use of antibiotics in animals — Categorisation of antimicrobials.
16. Виноградова АГ, Кузьменков АЮ, Трушин ИВ. Мониторинг антибиотикорезистентности с использованием платформы AMRcloud. Практическое руководство. — СГМУ: Смоленск, 2021. — 160 с.: ил.
https://monitoring.amrcloud.net
17. OIE list of critical antimicrobials
https://www.woah.org/app/uploads/2021/03/oie-list-antimicrobials.pdf
18. Государственный реестр лекарственных средств для ветеринарного применения
https://galen.vetrf.ru/#/registry/pharm/registry?page%20=%201
19. EUCAST. MIC and zone diameter distributions and ECOFFs
https://www.eucast.org/mic_and_zone_distributions_and_ecoffs
20. EUCAST. Clinical breakpoints — breakpoints and guidance
https://www.eucast.org/clinical_breakpoints
21. СLSI. Global Laboratory Standards for a Healthier World
22. CLSI M100 ED32:2022 Performance Standards for Antimicrobial Susceptibility Testing, 32nd Edition
http://em100.edaptivedocs.net/GetDoc.aspx?doc%20=%20CLSI%20M100%20ED32:2022&scope%20=%20user
23. Рекомендации МАКМАХ «Определение чувствительности микроорганизмов к антимикробным препаратам (2021)»
https://www.antibiotic.ru/minzdrav/category/clinical-recommendations
24. International Standard ISO 20776–1:2019. Susceptibility testing of infectious agents and evaluation of performance of antimicrobial susceptibility test devices — Part 1: Broth micro-dilution reference method for testing the in vitro activity of antimicrobial agents against rapidly growing aerobic bacteria involved in infectious diseases
https://www.iso.org/standard/70464.html
25. International Standard ISO 20776–2:2021. Clinical laboratory testing and in vitro diagnostic test systems — Susceptibility testing of infectious agents and evaluation of performance of antimicrobial susceptibility test devices — Part 2: Evaluation of performance of antimicrobial susceptibility test devices against reference broth micro-dilution
https://www.iso.org/standard/79377.html
26. Makarov DA, Ivanova OE, Pomazkova AV, Egoreva MA, Prasolova OV, Lenev SV, Gergel MA, Bukova NK, Karabanov SY. Antimicrobial resistance of commensal Enterococcus faecalis and Enterococcus faecium from foodproducing animals in Russia. Vet World. 2022;15(3):611–621
http://www.veterinaryworld.org/Vol.15/March-2022/9.html
27. Makarov DA, Ivanova OE, Karabanov SY, Gergel MA, Pomazkova AV. Antimicrobial resistance of commensal Escherichia coli from food-producing animals in Russia. Vet World, 2020; 13(10): 2053–2061
http://www.veterinaryworld.org/Vol.13/October-2020/3.html